BSC Organic Chemistry Hybridization Benzene free radical Notes
BSC Organic Chemistry Hybridization Benzene free radical Notes:-
प्रश्न 1. निम्नलिखित में से किन्हीं तीन पर संक्षिप्त टिप्पणियाँ लिखिए
(1) अतिसंयुग्मन (हाइपरकॉन्जुगेशन) (II) प्रेरणिक प्रभाव (III) अनुनाद
(IV) वियोजन
उत्तर : (I) अतिसंयुग्मन
(बन्धहीन अनुनाद या हाइपरकॉन्जुगेशन)
जब एक बहुबन्ध के ग-इलेक्ट्रॉन aC—H बन्ध के सिग्मा (σ) इलेक्ट्रॉनों के साथ संयुग्मन में होते हैं तो C—H बन्ध के σ—इलेक्ट्रॉनों का विस्थानीकरण हो जाता है। इस घटना को अतिसंयुग्मन या a — π संयुग्मन कहते हैं। इसे बेकर तथा नाथन ने प्रस्तुत किया था जिस कारण इसको बेकर-नाथन प्रभाव भी कहते हैं।
‘निकाय H-C-C=C में C-H बन्ध के σ—इलेक्ट्रॉन असंतृप्त कार्बन श्रृंखला में मुक्त हो जाते हैं। इसी घटना को अतिसंयुग्मन कहा जाता है।

(इसमें σ—इलेक्ट्रॉनों का संयुग्मन σ—इलेक्ट्रॉनों की ओर होता है)
H-Ca बन्ध के H—परमाणु पर धनावेश आ जाता है, परन्तु यह H—परमाणु इस a—कार्बन परमाणु पर ही रहता है यद्यपि दोनों परमाणुओं के मध्य कोई बन्ध नहीं होता है। इसलिए अतिसंयुग्मन को बन्धहीन अनुनाद भी कहते हैं।
किसी असंतृप्त कार्बन परमाणु निकाय से जितने अधिक a C—H σ—बन्ध जुड़े होंगे, असंतृप्त कार्बन श्रृंखला में उतने ही अधिक C—H इलेक्ट्रॉन मुक्त होंगे तथा अनुनादी संरचनाएँ, उतनी ही अधिक संख्या में होंगी।
अत: अतिसंयुग्मन दो दशाओं में सम्भव हैं— (i) जब निकाय संयुग्मी हो तथा (ii) उस निकाय में π—आबन्ध के सापेक्ष aC—σH आबन्ध विद्यमान हो।
उदाहरण— प्रोपिलीन अणु में तीन a C-H सिग्मा बन्ध हैं जो कि π—बन्ध के साथ संयुग्मन में हैं। अतः इसके लिए केवल तीन निम्नांकित बन्धहीन अनुनादी संरचनाएँ लिखी जा सकती हैं—

1-ब्यूटीन के अणु में C=C द्विबन्ध (π—इलेक्ट्रॉनों) के साथ संयुग्मन में केवल दो aC—H बन्ध हैं। अत: इस अणु के लिए केवल दो बन्धहीन अनुनादी संरचनाएँ लिखी जा सकती हैं।

विपरीत अतिसंयुग्मन— अतिसंयुग्मन की घटना निकाय Cl—C—C=CH होती है, परन्तु इस निकाय में ओलिफिनिक समूह के π-इलेक्ट्रॉन आकर्षित कर लिए जा अर्थात् σ-इलेक्ट्रॉनों का विस्थापन विपरीत दिशा में हो जाता है। अतः इस अतिसयुग्मा विपरीत अतिसंयुग्मन कहते हैं, अर्थात् इसमें π-इलेक्ट्रॉनों का संयुग्मन σ-इलेक्ट्रॉनों का होता है।

(II) नोट–अतिसंयुग्मन के लाक्षणिक गुण अनुनाद के समान होते हैं, परन्तु अनुनाद की तुलना में यह दुर्बल होता है।
अतिसंयुग्मन के अनुप्रयोग
- ऐल्कीनों का स्थायित्व— ऐल्किलीकृत ऐल्कीन अन्य ऐल्कीनों की अपेक्षा अधिक स्थायी होती हैं। किसी ऐल्कीन में ऐल्किल समूहों की संख्या जितनी अधिक होती है, उतना ही अधिक उसका स्थायित्व होता है जिसका कारण अतिसंयुग्मन है। अतः ऐल्कीनों के स्थायित्व का घटता हुआ क्रम निम्नवत् है—

किसी ऐल्कीन के अणु में जितने अधिक a C_H बन्ध होंगे, उसकी अतिसंयुग्मित संरचनाएँ (बन्धहीन अनुनाद संरचनाएँ) उतनी ही अधिक होंगी। अत: ऐल्कीन का स्थायित्व उतना ही अधिक होगा। उदाहरणार्थ—एथीन की अपेक्षा प्रोपीन अधिक स्थायी है।


(नोट-अधिक स्थायी ऐल्कीन की हाइड्रोजनीकरण ऊष्मा का मान कम होता है।)
- कार्बनिक मक्त मलकों का स्थायित्व— इनका स्थायित्व कार्बन पर उपस्थित समह की प्रकृति पर निर्भर करता है।
कार्बन परमाणु पर ऐल्किल समूहों की उपस्थिति मुक्त मूलक के स्थायित्व को बढ़ा देती है, अत: ऐल्किल मूलकों के स्थायित्व का घटता हुआ क्रम निम्नवत् है

ऐल्किल मुक्त मूलकों के स्थायित्व को अतिसंयुग्मन के आधार पर समझाया जा सकता है क्योंकि टर्शियरी ब्यूटिल मुक्त मूलक में 9 a C—H बन्ध, आइसोप्रोपिल मुक्त मूलक में 6a C—H बन्ध, एथिल मुक्त मूलक में 3 a C—H बन्ध होने के कारण अतिसंयुग्मन के आधार पर क्रमश: 9, 6 तथा 3 अतिसंयुग्मित संरचनाएँ सम्भव हैं।
किसी ऐल्किल मुक्त मूलक की अतिसंयुग्मित संरचनाओं की संख्या जितनी अधिक होती है, उसका स्थायित्व भी उतना ही अधिक होता है। एथिल मुक्त मूलक निम्नलिखित अतिसंयुग्मित संरचनाओं का अनुनाद संकर है—

- ऐल्किल कार्बोधनायनों का स्थायित्व— कार्बन-हाइड्रोजन (C-H) बन्ध के सिग्मा इलेक्ट्रॉन एक रिक्त p-कक्षक के साथ भी संयुग्मित हो सकते हैं।
उदाहरण— एथिल कार्बोधनायन में।

ऐल्किल कार्बोधनायन का स्थायित्व अतिसंयुग्मित संरचनाओं की संख्या के समानुपाता होता है. अर्थात कार्बोधनायन में उपस्थित a C-H बन्धों की संख्या के समानुपाती होता है। अतः ऐल्किल कार्बोधनायनों के स्थायित्व का घटता हुआ क्रम अग्रवत् है—
उदाहरण—

- समूहों का दैशिक प्रभाव-टॉलूईन अणु में मेथिल समूह सक्रियता कारक है तथा इसका दैशिक प्रभाव ऑर्थो तथा पैरा है। इसे अतिसंयुग्मन द्वारा समझाया जा सकता है।

अतिसंयुग्मन के कारण इलेक्ट्रॉनों का विस्थापन बेन्जीन रिंग की ओर होता है, अतः ऑर्थो तथा पैरा दोनों स्थितियों पर इलेक्ट्रॉन घनत्व बढ़ जाता है। इसके परिणामस्वरूप बेन्जीन रिग का सक्रियण हो जाता है तथा टॉलूईन अणु में इलेक्ट्रोफिलिक प्रतिस्थापन ऑर्थो तथा पैरा स्थितियों पर होता है। बेन्जोट्राइक्लोराइड अणु में – CCl3 समूह के विसक्रियण तथा मेटा देशिक प्रभाव को प्रतिलोम अतिसंयग्मन द्वारा समझाया जा सकता है।

यह स्पष्ट है कि इलेक्ट्रॉनों का प्रवाह बेन्जीन रिंग से दूर होता है। इसके फलस्वरूप ऑन तथा पैरा दोनों स्थितियों पर इलेक्ट्रॉन घनत्व कम हो जाता है। अत: बेन्जोट्राइक्लोराइड अण बेन्जीन रिंग में इलेक्ट्रोफिलिक प्रतिस्थापन मेटा स्थिति में होगा।
(II) प्रेरणिक प्रभाव या संचरण प्रभाव
जब दो समान विद्युत ऋणात्मकता वाले परमाणु इलेक्ट्रॉनों की पारस्परिक साझेदारी द्वारा सहसंयोजी आबन्ध बनाते हैं तो साझे का इलेक्ट्रॉन युग्म सममित रूप से दोनों परमाणुओं के मध्य रहता है, जैसे-Cl : Cl, H3C : CH3, आदि। परन्तु जब सहसंयोजी परमाणुओं की विद्युत ऋणात्मकता भिन्न होती है तो साझे का इलेक्ट्रॉन युग्म अधिक विद्युत ऋणात्मकता वाले | यह परमाणु की ओर विस्थापित हो जाता है, जिससे इस परमाणु पर आंशिक ऋणावेश (δ–) तथा नया दूसरे परमाणु पर समान धनावेश (δ+) उत्पन्न हो जाता है, जैसे—Hδ+ : Clδ–, H3C δ+ : C δ– आदि।
यदि कार्बनिक यौगिक में दो से अधिक कार्बन परमाणु शृंखलित हों तथा कार्बन श्रृंखला के सिरे पर अधिक विद्युत ऋणात्मकता वाला परमाणु जुड़ा हो जैसे कि C—X आबन्ध हो तो आबन्धं के इलेक्ट्रॉन X की ओर विस्थापित हो जाते हैं। जिससे X पर आंशिक ऋणावेश (Xδ−) व इससे जुड़े कार्बन पर आंशिक धनावेश (Cδ+) उत्पन्न हो जाता है। धनावेशित कार्बन परमाणु से जुड़े दूसरे कार्बन पर भी इसका प्रभाव पड़ता है जिससे इस पर भी कुछ धनावेश उत्पन्न हो जाता है परन्तु यह प्रथम कार्बन के धनावेश से कम होता है।

इस कार्बन श्रृंखला में भिन्न विद्युत ऋणात्मकता के परमाणु (या समूह) द्वारा इस प्रकार के इलेक्ट्रॉन युग्म विस्थापन को प्रेरणिक या संचरण प्रभाव कहते हैं। इसी प्रकार कार्बन श्रृंखला के सिरे पर इलेक्ट्रॉन प्रतिकर्षी समूह जैसे—CH3, के जुड़े होने पर इलेक्ट्रॉन विस्थापन श्रृंखला में – CH3 से दूर होता है जिससे −CH3 पर आंशिक धनावेश (δ+) तथा इससे जुड़े प्रथम कार्बन पर आंशिक ऋणावेश (δ−) तथा दूसरे कार्बन पर और भी कम । ऋणावेश (δδ−) उत्पन्न हो जाता है।

प्रेरणिक प्रभाव की विशेषताएँ— प्रेरणिक प्रभाव की प्रमुख विशेषताएँ निन प्रकार हैं−
- यह एक स्थायी ध्रुवण प्रभाव (permanent polarisation effect) है। इस संकेत द्वारा प्रकट किया जाता है।
- इस प्रभाव को आबन्ध पर तीर के चिह्न द्वारा (→−) दर्शाया जाता है। तीर की दिशा लेटॉन युग्म विस्थापन की दिशा होती है।
- σ−आबन्धों की बनी कार्बन शृंखला में इलेक्ट्रॉन युग्म का विस्थापन आंशिक होता है पूर्ण नही इसीलिए इसे δ+ या δ− चिह्न से व्यक्त किया जाता है, + या – चिह्न से नहीं।
- शृंखला में प्रेरणिक प्रभाव उत्पन्न करने वाले परमाणु (या समूह) से दूरी बढ़ने पर इसका प्रभाव कम होता जाता है व तीसरे कार्बन के पश्चात् यह प्रभाव नगण्य हो जाता है।
- परमाणुओं में ध्रुवणता परिवर्तन एक ही दिशा में होता है।
- प्रेरणिक प्रभाव का आकलन हाइड्रोजन के सापेक्ष किया जाता है। जो परमाणु या मह हाइडोजन की तुलना में अधिक इलेक्ट्रॉन आकर्षी होते हैं उनके प्रेरणिक प्रभाव को − I नथा जो परमाणु या समूह हाइड्रोजन के सापेक्ष कम इलेक्ट्रॉन आकर्षी होते हैं उनके प्रभाव को + I से प्रदर्शित किया जाता है।
ऋणात्मक प्रेरणिक (−I) प्रभाव− विभिन्न परमाणुओं/समूहों का ऋणात्मक प्रेरणिक – I) प्रभाव का घटता क्रम निम्न प्रकार है−

धनात्मक प्रेरणिक (+I) प्रभाव− कुछ सामान्य समूहों का धनात्मक प्रेरणिक (+I) – प्रभाव घटते हुए क्रम में निम्न प्रकार है

नोट− यह क्रम इनगोल्ड (Ingold) के अनुसार है। रोबिन्सन (Robinson) ने इलक्ट्रान आकर्षी परमाणु/समूह द्वारा उत्पन्न प्रेरणिक प्रभाव को + I प्रभाव तथा इलेक्ट्रॉन प्रतिकर्षी परमाणु समूह द्वारा उत्पन्न प्रेरणिक प्रभाव को-I प्रभाव कहा जो कि प्रचलित नहीं है।
प्ररणिक प्रभाव के अनुप्रयोग− इस प्रभाव के महत्त्वपूर्ण अनुप्रयोग निम्नलिखित हैं—
- बन्ध दूरी− ऐल्किल हैलाइडों में हैलोजेन में −F से −I तक −I प्रभाव घटने के कारण C−X बन्ध के ध्रुवों के मध्य आकर्षण बल का मान घटता जाता है, फलस्वरूप C−X (C−F से C−I तक) क्रमशः बढ़ती जाती हैं।
जैसे

- द्विधुव-आघुण—प्रेरणिक प्रभाव के कारण द्विध्रुव उत्पन्न हो जाते हैं, फलस्वरूप सयाजा यौगिकों में आयनिक गण उत्पन्न हो जाता है। जैसे-जैसे प्रेरणिक प्रभाव बढ़ता जाता है वैसे-वैसे आयनिक गण भी बढ़ता जाता है और द्विध्रव-आघूर्ण का मान भी बढ़ता जाता है जैसे ऐल्किल हैलाइडों में।

(−I प्रभाव का बढ़ता क्रम I < Br < Cl < F) जो इनकी विद्युत ऋणात्मकता के पर आधारित है।
- वसीय अम्लों की प्रबलता का क्रम ज्ञात करने में— वसीय अम्लों में प्रबलता। क्रम निम्नवत् है–

क्योंकि जैसे-जैसे ऐल्किल समूह का +I प्रभाव बढ़ता जाता है, अम्ल की प्रबलत क्रमशः घटती जाती हैं।
वसीय अम्ल कार्बोक्सिलिक समूह से H+ आयन (प्रोटॉन) देकर कार्बोक्सिले (RCOO−) के रूप में ऋणायन बनाते हैं जो अनुनाद संरचनाओं के कारण स्थायी होता है

कार्बोक्सिलेट समूह में ऐल्किल समूह बढ़ने के साथ-साथ +I प्रभाव का मान बढ़ता जाता है क्योंकि कार्बोक्सिलेट समूह पर ऋणावेश का मान बढ़ता है, फलस्वरूप प्रतिकर्षण कारण कार्बोक्सिलेट समूह का स्थायित्व घटता जाता है और प्रोटॉन बनाने की दर घटा ‘जाती है अर्थात् अम्लीय गुण घटता जाता है।
+I प्रभाव का बढ़ता क्रम

(क्योंकि CH3 – समूह के +I प्रभाव के कारण ऐसीटेट आयन फार्मेट आयन से कम
स्थायी होता है)
अम्लों की प्रबलता « प्रोटॉन बनने की दर
- हैलोजेनीकृत वसीय अम्लों की प्रबलताओं के क्रम ज्ञात करने में जैसे मोनो, लाडक्लोरो ऐसीटिक अम्लों में प्रबलताओं का क्रम निम्न प्रकार है

उपर्युक्त उदाहरणों में Cl- परमाणु – I प्रभाव व्यक्त करता है जिसके फलस्वरूप प्रोटॉन दान करके बने कार्बोक्सिलेट (ऋणायन) पर Cl- परमाणु बढ़ने पर ऋणावेश का मान घटता जाता है और उसका स्थायित्व बढ़ता जाता है।
इस प्रकार ऋणायन का स्थायित्व बढ़ने पर प्रोटॉन (H+ ) बनने की दर बढ़ती जाती है, फलस्वरूप अम्लों की प्रबलताएँ बढ़ती जाती है। अत: वसीय अम्लों में – COOH समूह के साथ –I प्रभाव व्यक्त करने वाला समूह संयुक्त होने पर उनकी प्रबलता बढ़ती है (जबकि +I समूह के प्रभाव से प्रबलता घटती है)।
इसी आधार पर -I प्रभाव हैलोजेन में -F से -I तक क्रमशः घटता है, फलस्वरूप मोनो हैलोजेनीकृत ऐसीटिक अम्लों में प्रबलता का क्रम निम्न प्रकार घटता है

क्योकि Cl- परमाणु -I प्रभाव व्यक्त करता है परन्तु यह प्रभाव दूरी बढ़ने पर क्रमशः घटता है अतः a, β व γ−क्लोरो ब्यूटिरिक अम्लों में Cl- परमाणु के -I प्रभाव का क्रम निम्न प्रकार है
α>β>γ>δ>…..
- ऐमीनों का क्षारकीय अभिलक्षण- ऐमीन अमोनिया के ऐल्किल या ऐरिल व्युत्पन्न होते हैं जिन पर नाइट्रोजन पर मुक्त इलेक्ट्रॉन युग्म (एकाकी इलेक्ट्रॉन युग्म) होता है जिसके कारण वे क्षारकीय गुण व्यक्त करते हैं तथा इनकी क्षारकीय प्रबलताएँ इनके इलेक्ट्रॉन युग्म दान करने की दर पर निर्भर करती हैं। अत: जो जितनी शीघ्रता से इलेक्ट्रॉन युग्म दान करता है। उतना ही अधिक प्रबलतम होता है। ऐमीन तीन प्रकार के होते हैं जो क्रमशः प्राथमिक विती र तथा तृतीयक कहलाते हैं।

ऐल्किल समूह +I प्रभाव के कारण ऐमीन के नाइट्रोजन के घनत्व को बढ़ा देता है। फलस्वरूप NH के सापेक्ष ऐलिफैटिक ऐमीन में इलेक्ट्रॉन युग्म दान करने की दर बढ़ जाती है।। अतः ऐमीन, अमोनिया की अपेक्षा प्रबल क्षारक होते हैं। +1 प्रभाव के कारण ऐमीनो के क्षारकीय अभिलक्षण का क्रम तृतीयक> द्वितीयक >प्राथमिक होना चाहिए। यह केवल गैसीय अवस्था के लिए सत्य है, परन्तु जलीय विलयन में इनकी क्षारकीयता का सही क्रम निम्न प्रकार है—
द्वितीयक > प्राथमिक > तृतीयक
ऐमीन यह क्रम त्रिविम प्रभाव की सहायता से स्पष्ट किया जाता है।
(III) अनुनाद
अनेक यौगिक या मूलक इस प्रकार के होते हैं कि उन्हें एक से अधिक संरचना सूत्रों द्वारा प्रदर्शित किया जा सकता है। इन संरचना सूत्रों में विभिन्न परमाणुओं के केन्द्रकों का विन्यास तो समान होता है, परन्तु इलेक्ट्रॉनों का विन्यास भिन्न होता है जैसे बेन्जीन अणु को किसी एक संरचना सूत्र द्वारा सही रूप से निरूपित नहीं किया जा सकता है, परन्तु बेन्जीन अणु को निम्नलिखित दो केकुले संरचनाओं (1 व II) द्वारा निरूपित करना संभव है।

बेन्जीन अणु की इन दो केकुले संरचनाओं में परमाणुओं की स्थिति समान है, परन्तु आबन्धों की स्थिति भिन्न है। इनमें से प्रत्येक संरचना बेन्जीन अणु के अधिकांश गुणों को स्पष्ट करती है परन्तु बेन्जीन का वास्तविक अणु इनमें से किसी भी एक संरचना द्वारा संतोषजनक रूप से प्रदर्शित नहीं किया जा सकता। किसी अणु की भिन्न इलेक्ट्रॉनिक विन्यास वाल संरचनाओं को अनुनादी संरचनाएँ कहते हैं। अणु की वास्तविक संरचना में योगदान कर वाली दो अनुनादी संरचनाओं को उनके मध्य दो शीर्षों का तीर (4→) लगाकर प्रदार करते हैं। चूँकि बेन्जीन की दो अनुनादी संरचनाएँ I व II समतुल्य हैं और ये दोनों समा स्थायित्व या समान ऊर्जा की हैं, इसलिए अनुनाद संकर में ये दोनों संरचनाएँ बराबर योगदा’
करती हैं। सुविधा के लिए बेन्जीन अणु की दो केकुले संरचनाओं I व II को अनुनाद संकर की “ST द्वारा प्रदर्शित करते हैं। इस प्रकार किसी अणु द्वारा अनुनाद संकर के रूप में रहने की परिघटना को अनुनाद (resonance) कहा जाता है। अतः जब कोई या मलक (आयन) अपने परमाणुओं की स्थिति परिवर्तित किए बिना एक से अधिक इलेक्ट्रॉनिक संरचनाएँ व्यक्त करता हो तो उन संरचनाओं को अनुनादी संरचनाएँ “हैं और उनके इस गुण को अनुनाद कहा जाता है।
किसी अणु की अनुनादी संरचनाएँ लिखने के लिए निम्नलिखित प्रमुख शर्तों का ध्यान रखना आवश्यक है- .
(i) अनुनाद में किसी अणु के विभिन्न संरचनात्मक सूत्रों में परमाणुओं की सापेक्ष स्थिति समान होनी चाहिए। केवल श-इलेक्ट्रॉन का स्थान परिवर्तन अथवा विस्थानीकरण (delocalisation) होता है।
(ii) सभी संभव संरचना सूत्रों में युग्मित या अयुग्मित इलेक्ट्रॉनों की संख्या भी समान होनी चाहिए।
CH2=CH-CH-O-CH2-CH=CH-Ö
(iii) सभी संभव संरचनाओं की आंतरिक ऊर्जा (या स्थायित्व) लगभग समान होनी चाहिए।
(iv) अनुनादी संरचनाओं में भाग लेने वाले सभी परमाणुओं का एक तल में होना आवश्यक होता है (जैसे—बेन्जीन अणु समषट्कोणीय और समतली है)।
अनुनाद के गुण- अनुनाद के प्रमुख गुण निम्न प्रकार हैं—
(i) अनुनादी संरचनाओं का स्थायित्व उपस्थित सहसंयोजी आबन्धों की संख्या पर निर्भर करता है। जितने अधिक सहसंयोजी आबन्ध होंगे वह संरचना उतनी ही अधिक स्थायी होगी।
CH3−C+=O ↔ CH3−C≡O+
(कम स्थायी) (अधिक स्थायी)
(ii) सामान्यत: अनावेशित संरचनाओं का स्थायित्व आवेशित संरचनाओं से अधिक होता है।

आवेशित सरचनाओं में अधिक विद्यत ऋणात्मक परमाणु पर ऋणावेश व कम विधुत ऋणात्मक
परमाणु पर धनावेश होने पर आवेशित संरचनाओं का स्थायित्व अधिक होता है इसके विपरीत होने पर स्थायित्व कम होता है।

(iii) अनुनादी योगदान, योगदायी संरचनाओं के तुल्य व कम ऊर्जा वाली होने की अधिक होता है।
C+H2−CH=CH2 ↔ CH2=CH−C+H2,
(iv) जो अणु या आयन अनुनाद का गुण व्यक्त करते हैं उनमें एक प्रकार के सभी आबन्धों की आबन्ध दूरी समान होती है जैसे बेन्जीन की केकुले संरचनाओं में।
(v) किसी अणु या आयन की समान ऊर्जा की जितनी अधिक अनुनादी संरचनाएँ लिखी जा सकती हैं, उसका अनुनाद संकर उतना ही अधिक स्थायी होता है जैसे बेन्जिल आयन (C6H5CH2,) की पाँच अनुनाद संरचनाएँ व ऐलिल आयन (CH2 =CH – C+H2) की दो अनुनाद संरचनाएँ लिखी जा सकती हैं। अत: इनमें बेन्जिल आयन ऐलिल आयन के सापेक्ष अधिक स्थायी होता है।
(vi) किसी यौगिक या आयन की अनुनाद संकर संरचना एक वास्तविक संरचना, है, जबकि अनुनादी संरचनाएँ काल्पनिक होती हैं।
अनुनाद के अनुप्रयोग- कार्बनिक रसायन में अनुनाद के महत्त्वपूर्ण अनुप्रयोग हैं जिनमें कुछ निम्नवत् स्पष्ट किए गए हैं—
(i) बेन्जीन की संरचना— अनुनाद की धारणा का प्रादुर्भाव बेन्जीन की संरचना निर्धारित करने में ही हुआ। बेन्जीन को निम्नांकित सम्भव संरचनाओं का अनुनाद संकर माना जाता है

केकुले के सूत्र लगभग 80% और डेवार के सूत्र केवल 20% बेन्जीन के गुणों को ” व्यक्त करते हैं। सभी सम्भव संरचनाओं से बने अनुनाद संकर में π-इलेक्ट्रॉन विस्थानित (delocalised) होकर इस प्रकार फैल जाते हैं कि इसमें न तो कोई एकल आबन्ध और न हा द्वि-आबन्ध रह जाता है। प्रयोग द्वारा बेन्जीन रिंग में C—C आबन्ध दूरी 1.39वें पायी गई है, जबकि C—C एकल आबन्ध की लम्बाई 1.54 A और द्वि-आबन्ध की लम्बाई 1.34 1 होती है। अत: बेन्जीन में C—C आबन्ध न तो एकल है न ही द्वि-आबन्ध वरन् इनके मध्यवता (midway) है। अनुनाद संकर को वलय में डॉटेड या ठोस वृत्त द्वारा निरूपित करते है।

(ii) द्विध्रुव-आघूर्ण- वाइनिल क्लोराइड का द्विध्रुव-आघूर्ण 1.44D है क्योंकि इसके अननाद संकर में इसकी संरचना II का योगदान होता है।
![]()
इसी प्रकार कार्बोनिल यौगिक, आइसोसायनाइड आदि अन्य कार्बनिक यौगिकों के द्विध्रुव-आघूर्ण की व्याख्या अनुनाद की सहायता से की जा सकती है।
(iii) आबन्ध लम्बाई- अनुनाद के कारण C—C, C=C, C=0 आबन्ध लम्बाइयों के भी असामान्य मान प्राप्त होते हैं, जैसे—बेन्जीन वलय (ring) में।
(iv) मुक्त मूलक या कार्बोकैटायन का स्थायित्व-किसी अणु की जितनी अधिक संरचनाएँ सम्भव हैं, वह उतना ही अधिक स्थायी होता है जैसे ट्राइफेनिल मेथिल मुक्त मूलक या कार्बोनियम आयन में अयुग्मित इलेक्ट्रॉन आवेश नौ स्थितियों ( 6 ऑर्थो + 3 पैरा ) पर जाकर विस्थानित (delocalised) हो जाता है, फलस्वरूप यह अधिक स्थायी है, अत: अनुनाद की सहायता से मुक्त मूलकों का स्थायित्व व्यक्त किया जा सकता है। इसी प्रकार ऐलिल मुक्त मूलक में स्थायित्व अनुनाद द्वारा व्यक्त किया जाता है।
CH2=CH—CH2 ↔ CH2-CH=CH2
(v) ऐसीटिलीन तथा अन्य ऐल्काइन-1 के H परमाणुओं की अम्लीयता समझने में।
(vi) कार्बोक्सिल आयन का स्थायित्व समझने में।
(vii) फीनॉल की अम्लीयता समझने में।
(viii) बेन्जीन के एक विस्थापन (monosubstitution) उत्पादों में लगे समूह का ऑर्थो, पैरा व मेटा निर्देशन प्रभाव समझने में।
- वियोजन
रेसिमिक मिश्रण का शुद्ध प्रतिबिम्बरूपों में पृथक्करण का प्रक्रम वियोजन कहलाता है।
इसके लिए प्रयुक्त विभिन्न विधियाँ निम्न प्रकार हैं __
- यान्त्रिक विधि— इस विधि का प्रतिपादन पाश्चर (1848) ने किया था। इसका प्रयोग केवल तभी किया जाता है जब दोनों प्रतिबिम्बरूप क्रिस्टलीय हों तथा उनके क्रिस्टलों की आकृति भिन्न-भिन्न हो।
- जैवरासायनिक विधि— इस विधि में किसी जीवाणु जैसे यीस्ट की रेसिमिक मिश्रण के तनु विलयन में वृद्धि करायी जाती है। यह रेसिमिक मिश्रण के किसी एक अवयव का उपयोग अपनी वृद्धि के लिए कर लेता है जबकि इस मिश्रण का अन्य अवयव शेष बच जाता है।
इस विधि द्वारा केवल एक ही प्रतिबिम्बरूप प्राप्त किया जा सकता है तथा उसकी भी लब्धि बहुत कम होती है क्योंकि जीवाणु को केवल तनु विलयन में उत्पन्न किया जा सकता है।
- रासायनिक विधि— यह वियोजन के लिए उपलब्ध विधियों में से सर्वोत्तम है। रेसिमिक मिश्रण को उपयुक्त प्रकाश सक्रिय यौगिक से अभिकृत करके दो अप्रतिबिम्ब (diastereomers) के मिश्रण में परिवर्तित कर लिया जाता है। चूंकि अप्रतिबिम्ब रूपों भौतिक गुणधर्म भिन्न-भिन्न होते हैं अत: इन्हें भौतिक विधियों जैसे प्रभाजी क्रिस्टलन, प्रभात आसंवन आदि के द्वारा सरलता से पृथक् कर सकते हैं। इस प्रकार प्राप्त प्रत्येक अप्रतिबिम्ब रूपा को उपयुक्त अभिकर्मक से अभिकृत करके मूल रेसिमिक मिश्रण में उपस्थित प्रतिबिम्बरूप को प्राप्त कर लेते हैं।
इस विधि का प्रयोग रेसिमिक क्षारकों, ऐल्कोहॉलों, ऐल्डिहाइड तथा कीटोन आदि पर किया जा सकता है परन्तु प्रत्येक विधि में एक भिन्न प्रकाश सक्रिय अभिकर्मक की आवश्यकता होती है।
- क्रोमैटोग्राफी विधि— इसके लिए स्तम्भ वर्णलेखन का प्रयोग किया जाता है। इसमें स्तम्भ में भरे अधिशोषक के पृष्ठ को किरैल पदार्थ द्वारा लेपित करके, रेसिमिक मिश्रण के उपयुक्त विलायक में निर्मित विलयन को इसमें से गुजारा जाता है।. मिश्रण में उपस्थित प्रतिबिम्बरूप, किरैल पदार्थ से संयोग करके दुर्बल जटिल प्रतिबिम्बरूप बनाते हैं। इनके भौतिक गुणों में अन्तर के आधार पर इन्हें पृथक् करके इनसे संगत प्रतिबिम्ब रूप को प्राप्त कर लिया जाता है।
प्रश्न 2. निम्नलिखित पर टिप्पणी लिखिए .
(I) मेसोमेरिक प्रभाव
(II) इलेक्ट्रोमेरिक प्रभाव
उत्तर : (I) मेसोमेरिक प्रभाव
यह एक स्थायी प्रभाव है जिसमें π-इलेक्ट्रॉनों या एकाकी इलेक्ट्रॉन युग्म का पूर्ण रूप से विस्थापन हो जाता है तथा जिसके फलस्वरूप धनात्मक तथा ऋणात्मक आवेश परमाणु पर आ जाता है। यह प्रभाव असंतृप्त यौगिकों के सामान्य अणु में सदैव पाया जाता है, जबकि इलेक्ट्रोमेरिक प्रभाव केवल आक्रमणकारी अभिकर्मक की उपस्थिति में ही कार्य करता है। मेसोमेरिक प्रभाव किसी अणु में एकाकी इलेक्ट्रॉन युग्म युक्त ऐसे परमाणु की उपस्थिति कारण होता है जो युग्म बन्ध के साथ संयुग्मन (conjugation) में उपस्थित रहता है; जैसे

मेसोमेरिक प्रभाव को एक मुड़े हुए तीर द्वारा प्रदर्शित करते हैं अत: मेसोमेरिक वह स्थायी प्रभाव है जिसमें किसी बहु (multiple) आबन्ध से 𝛑-इलेक्ट्रॉन का परमाणु की ओर विस्थापन होता है।
प्रायः इलेक्ट्रॉनों का विस्थापन अधिक ऋणविद्युती परमाणु की ओर होता है लेकिन जब अधिक ऋणविद्युती परमाणु का एकाकी इलेक्ट्रॉन युग्म (lone pair of electron) द्विबन्ध के साथ संयुग्मन (conjugation) में उपस्थित होता है, तब इलेक्ट्रॉन का स्थानान्तरण अधिक ऋणविद्युती परमाणु की ओर न होकर उससे विपरीत होता है जैसे मेथिल विनाइल ईथर तथा ऐक्रोलीन में मेसोमेरिक प्रभाव।

ऐक्रोलीन में इलेक्ट्रॉन का स्थानान्तरण अधिक ऋणविद्युती ऑक्सीजन की ओर होता है, लेकिन मेथिल विनाइल ईथर में इलेक्ट्रॉन का स्थानान्तरण ऑक्सीजन में से ग-इलेक्ट्रॉन की
ओर हो रहा है क्योंकि मेथिल विनाइल ईथर में ऑक्सीजन का एकाकी. इलेक्ट्रॉन युग्म संयुग्मन . में तथा ऐक्रोलीन यौगिक में ऑक्सीजन परमाण संयुग्मन में है।
प्रेरणिक प्रभाव की भाँति मेसोमेरिक प्रभाव भी धनात्मक और ऋणात्मक होता है जिसे + M और – M से दर्शाते हैं। अगर इलेक्ट्रॉनों का स्थानान्तरण किसी विद्युत ऋणात्मक परमाणु की ओर होता है तो इसे ऋणात्मक मेसोमेरिक प्रभाव (-M) कहते हैं; जैसे—

-M प्रभाव वाले परमाणु या समूह—

इसी प्रकार यदि इलेक्ट्रॉनों का स्थानान्तरण किसी विद्युत ऋणात्मक परमाणु से दर होता है तो इसे धनात्मक मेसोमेरिक प्रभाव (+ M) कहते हैं; जैसे—

+ M प्रभाव वाले परमाणु या समूह—
—Cl, —Br, —I, —NH2, —NR2, —OH, —OCH3 आदि। यह प्रभाव ऐरोमैटिक यौगिकों में भी पाया जाता है। ऐसे ऐरोमैटिक यौगिक जिनमें कोई X: समूह (जिसके पास एकाकी इलेक्ट्रॉन युग्म होता है) फेनिल या बेन्जीन समूह के साथ सीधे जुड़ा हो तो एकाकी इलेक्ट्रॉन युग्म बेन्जीन नाभिक के साथ संयुग्मित (conjugated) हो जाता है। यह प्रभाव + M प्रभाव कहलाता है।

मेसोमेरिक प्रभाव एक स्थायी प्रभाव है जो कि अभिक्रियाकारी अणु में सदैव उपर रहता है।
(II) इलेक्ट्रोमेरिक प्रभाव
यह एक अस्थायी ध्रुवणीयता (polarisability) प्रभाव है जो किसी आक्रमणकारी अभिकर्मक की उपस्थिति में ही प्रभावकारी होता है तथा आक्रमणकारी अभिकर्मक (attacking agent) हटा लेने पर अणु अपनी पूर्व इलेक्ट्रॉनिक अवस्था में आ जाता है। यह प्रभाव अभिक्रिया में सहायक तो होता है किन्तु बाधक नहीं हो सकता। यह प्रभाव द्वि- व त्रि आबन्धी यौगिकों में ही प्रदर्शित होता है। इस प्रभाव में अभिकर्मक की उपस्थिति में सहसंयोजी आबन्ध का इलेक्ट्रॉन युग्म पूर्ण रूप से पहले अथवा दूसरे परमाणु पर विस्थापित हो जाता है। जिस परमाणु पर इलेक्ट्रॉन युग्म विस्थापित हो जाता है उस पर ऋणावेश (-) तथा जिस परमाणु से विस्थापित हो जाता है उस पर धनावेश (+) उत्पन्न हो जाता है। जब अभिकर्मक को हटा लिया जाता है तो आवेशित बहुआबन्धी अणु अपनी प्रारम्भिक अवस्था (अनावेशित) में आ जाता है। अत: आक्रमणकारी अभिकर्मक की उपस्थिति में किसी बहुआबन्ध (multiple bonds) वाले यौगिक में इस आबन्ध से साझे के ग-इलेक्ट्रॉन युग्म का किसी एक परमाणु पर पूर्ण स्थानान्तरित हो जाना इलेक्ट्रोमेरिक प्रभाव कहलाता है। इस प्रभाव को वक्रीय तीर (A) द्वारा प्रदर्शित किया जाता है तथा ‘E’ संकेत के द्वारा दर्शाया जाता है।

वक्रीय तीर का आधार ग-इलेक्ट्रॉन युग्म की पूर्ववत् अवस्था को तथा तीर का शा को प्रदर्शित करता है जहाँ कि इलेक्ट्रॉन युग्म का विस्थापन होता है। CH=CH2M. जैसे समित यौगिकों में 7-इलेक्ट्रॉन के विस्थापन की दिशा दाएँ या बाएँ किसी भी और हो सकती है परन्तु c=0 जैसे असममित यौगिकों में 7-इलेक्ट्रॉन यग्म सदैव आधिक आणात्मकता वाले परमाणु (यहाँ ऑक्सीजन) की ओर विस्थापित होती है
इलेक्टोमेरिक प्रभाव के अनुप्रयोग- इलेक्ट्रोमेरिक प्रभाव के अनुप्रयोग निम्न प्रकार हैं
- ऐल्कीन पर हैलोजेन अम्ल की योगात्मक अभिक्रिया- यह एक इलेक्ट्रॉनस्नेही प्रक्रिया है। इस अभिक्रिया में ऐल्कीन का π-इलेक्ट्रॉन युग्म, हैलोजेन अम्ल से प्राप्त प्रोटॉन (इलेक्ट्रोफाइल) की आवश्यकतानुसार एक कार्बन से दूसरे कार्बन की ओर पूर्ण रूप से विस्थापित हो जाता है। सममित ऐल्कीन में इलेक्ट्रॉन विस्थापन की दिशा दो कार्बन परमाणुओं में किसी ओर भी हो सकती है परन्तु असममित ऐल्कीन में इलेक्ट्रॉन युग्म ऐल्कीन से जुड़े +I प्रभाव वाले समूह से दूर वाले (या –I प्रभाव वाले समूह की ओर वाले) कार्बन परमाणु कीओर होता है। इस इलेक्ट्रोमेरिक प्रभाव को निम्न प्रकार दर्शाया जा सकता है

- कार्बोनिल समूह पर HCN की अभिक्रिया-यह एक नाभिकस्नेही अभिक्रिया है। ऐल्डिहाइड या कीटोन का ग-इलेक्ट्रॉन युग्म HCN की उपस्थिति में कार्बन से ऑक्सीजन की आर पूर्ण रूप से विस्थापित हो जाता है जिससे कार्बन धनावेशित व ऑक्सीजन ऋणावेशित हो जाता है। धनावेशित कार्बन ऋणावेशित ऑक्सीजन से अधिक क्रियाशील होने के कारण (ऋणावेशित ऑक्सीजन का अष्टक पूर्ण हो जाने के कारण अधिक स्थायी है) नाभिकस्नेही (CN) के लिए सुग्राही हो जाता है जिससे CN समूह कार्बोनिल कार्बन पर आक्रमण कर C-CN आबन्ध बना लेता है। पुनः H+ और 0-आयन आपस में योग कर 0-H आबन्ध बना लेते हैं।

इलेक्ट्रोमेरिक प्रभाव दो प्रकार के होते हैं
- घनत्वक इलेक्ट्रोमेरिक प्रभाव (+ E प्रभाव)— इस प्रभाव में बहआबन्ध[बहूबन्ध (multiple bonds)] के ग-इलेक्टॉनों का स्थानान्तरण उस परमाण पर होता है। जिस पर आक्रमणकारी अभिकर्मक बन्धित होता है। उदाहरणार्थ—

- ऋणात्मक इलेक्ट्रोमेरिक प्रभाव (- E प्रभाव)— इस प्रभाव में बहुआबन्ध [बहुबन्ध (multiple bonds)] के श-इलेक्ट्रॉनों का स्थानान्तरण उस परमाणु पर होता है, . जिससे आक्रमणकारी अभिकर्मक बन्धित नहीं होता है। उदाहरणार्थ—

प्रश्न 3. संकरण से आप क्या समझते हैं? संकरण के प्रमुख नियमों को स्पष्ट करके कार्बनिक यौगिकों में विभिन्न प्रकार के संकरणों को उदाहरण सहित समझाइए।’
उत्तर : संकरण
ऐसे लाखों कार्बनिक यौगिक ज्ञात हैं जिनमें कार्बन की संयोजकता चार है: जैसे—CH4, CCl4, CH3-CH3 आदि। इन यौगिकों की ज्यामिति एवं प्रायोगिक तथ्यों को समझाने हेतु पॉलिंग एवं स्लेटर ने एक काल्पनिक धारणा प्रस्तुत की थी जिसे संकरण कहा गया।
इन यौगिकों के बनने को कक्षकों के संकरण के आधार पर समझाया जा सकता है। कार्बन का इलेक्ट्रॉनिक विन्यास चित्र-9 (अ) में दिखाया गया है। क्योंकि चित्र-9 (अ) में अर्थात् मूल अवस्था में केवल दो 2p-कक्षके आधा भरी हई हैं, इसलिए यह हाइड्रोजन या क्लोरीन के साथ दो बन्ध बना सकता है परन्तु इनके साथ चार बन्ध बनाता है जिसे पॉलिग एवं स्लेटर की संकरण की धारणा से समझाया जा सकता है इस धारणा के अनुसार उत्तेजित अवस्था में एक इलेक्ट्रॉन 2δ-कक्षक से 2p-कक्षक में कूद जाता है [चित्र-9 (ब)] जिससे इसमें चार आधी भरी हुई अवस्था की कक्षक: 2s1,2p1x2p1Z होंगी, परन्तु इन कक्षकों की ऊर्जा अलग-अलग होती है। कक्षकों की उर्जा समान करने हेतु ये कक्षक मिश्रित होकर ऊर्जा का पुनर्वितरण इस प्रकार से करते हैं कि चारों मान हो जाती है क्योंकि कार्बन की चारों संयोजकताएँ समान होती हैं।

वह घटना जिसमें व्यक्तिगत परमाणुओं की बाह्यतम कक्षकों की ऊर्जा मिश्रित होकर समान हो जाती है, संकरण कहलाती है।
अतः संकरण वह घटना है जिसमें किसी परमाणु की बाह्यतम कक्ष के लगभग समान ऊर्जा वाले कक्षकों को मिश्रित करके समान संख्या के बिल्कुल नए कक्षक प्राप्त होते हैं जिनकी ऊर्जा तथा आकार समान होते हैं। संकरण के नियम
संकरण के लिए आवश्यक परिस्थितियाँ निम्नवत् हैं—
(1) केवल एकल परमाणु के बाह्यतम कक्ष के असमान कक्षकों का संकरण हो सकता है।
(2) जिन कक्षकों का संकरण होना है, उनकी ऊर्जा लगभग समान होनी चाहिए, अर्थात् एक ही ऊर्जा स्तर की कक्षकें संकरित हो सकती हैं जैसे 2s तथा 2p-कक्षकें संकरित हो सकती हैं, अर्थात् एक कक्ष की 8-कक्षक सीधी d-कक्षक से संकरित नहीं होती है।
(3) जितने कक्षक संकरण में भाग लेंगे उतनी ही नई संकरित कक्षकें बनती हैं जैसे sp°-संकरण में एक s तथा तीन p-कक्षकें संकरित होकर चार sp3-संकरित कक्षकों का निर्माण करती हैं। ये सभी कक्षके समान होती हैं।
(4) केवल कक्षकों का संकरण होता है, इलेक्ट्रॉनों का नहीं। यदि S2 p1x, p1y,p1z कक्षकों के संकरण से संकरित कक्षकें बनती हैं तो इन sp3- संकरित कक्षकों में एक कक्षक युग्मित तथा अन्य कक्षकों में एक-एक इलेक्ट्रॉन होंगे।
(5) संकरित कक्षकों का दिशात्मक लक्षण प्रमुख कक्षक द्वारा निर्धारित होता है। उदाहरणार्थ-sp3-संकरण में s-कक्षक अदिशात्मक है, इसलिए इसकी दिशा पर कोई प्रभाव नहीं पड़ेगा, परन्तु p-कक्षकें संकरित कक्षकों की दिशा को प्रभावित करती हैं।
(6) संकरण के प्रकार के आधार पर अणु की ज्यामिति तथा बन्धन कोण की प्रकृति ज्ञात की जा सकती है।
(7) संकरित कक्षक आपस में समान होती हैं किन्तु त्रिविम क्षेत्र में इनका अभिविन्यास भिन्न हो सकता है।
(8) संकरित कक्षक (युग्मित को छोड़कर) अपने अक्ष पर अतिव्यापन से सदैव सिग्मा बन्ध बनाती हैं अर्थात् अपने अक्ष पर ही अतिव्यापन में भाग लेती हैं (संकरित युग्मित कक्षकों को छोड़कर)।
(9) यह आवश्यक नहीं कि परमाणु की बाह्यतम कक्ष में विद्यमान सभा भाग लें बल्कि यह संकरण की प्रकृति पर निर्भर करता है। ऐसी अवस्था में जा में भाग नहीं लेती हैं, उन्हें असंकरित कक्षक कहते हैं जो सदैव पार्श्ववती आत π-बन्ध का निर्माण करती हैं।
विभिन्न यौगिकों में विभिन्न प्रकार से संकरण होता है. परन्त कार्बनिक रसायन में प्रयुक्त संकरण निम्नलिखित हैं
(i) sp-संकरण- जब एक परमाणु की बाह्यतम कक्ष की ‘s’ व एक ‘p’ कक्षक मिाश्रत | होकर दो नई समान संकरित कक्षक बनाती हैं तो इस संकरण को sp-संकरण कहते हैं तथा इन कक्षकों को sp-संकरित कक्षक कहते हैं। यह संकर बन्ध एक-रैखिक होता है और दो| कक्षकों के बीच 180° का कोण बनता है। ‘sp’-कक्षक में दो मुण्ड होते हैं जिनमें एक बड़ा और दूसरा छोटा होता है। इस प्रकार के संकरण में बनने वाले अणु की आकृति रेखीय होती है।

उदाहरण—
ऐसीटिलीन की संरचना— ऐसीटिलीन में प्रत्येक C परमाणु का एक 2 s-कक्षक एवं एक 2 p-कक्षक संकरित होकर दो sp-संकरित कक्षक बनाते हैं। इसमें से एक संकर कक्षा एक H परमाणु के 1 8-कक्षक से एकरेखीय अतिव्यापन करके सिग्मा बन्ध बनाता है तथ दूसरा संकर कक्षक C-C के बीच रेखीय अतिव्यापन करके सिग्मा (σ) बन्ध बनाने में प्रयुक् होता है। दोनों कार्बन परमाणुओं के बीच दो-दो असंकरित p-कक्षक अभी भी अर्द्धपूर्ण हैं| रहते हैं, जो पार्श्व अतिव्यापन करके पाई (π) बन्धों का निर्माण करते हैं। अत: ऐसीटिलीन अणु में दो कार्बन परमाणुओं के बीच एक सिग्मा (σ) तथा दो पाई (π) बन्ध बनते हैं, जबगि इसके अणु का आकार रेखीय है

(ii) sp2-संकरण— जब एक परमाणु की बाह्यतम कक्ष की आधी भरी एक p-कक्षकें परस्पर मिश्रित होकर तीन समान संकरित कक्षकों का निर्माण करती है । कक्षकों को sp2-संकरित कक्षक कहते हैं तथा उस संकरण को sp2-संकरण कह तरह बने तीनों बन्ध कक्षकों में परस्पर विकर्षण होता है जिसके कारण वे एक रहते हैं तथा किन्दी दो बन्धों के बीच 120° का कोण रहता है। इस प्रकार के संकरण से बनने आण की आकृति त्रिकोणीय होती है

उदाहरण .. एथिलीन की संरचना—एथिलीन में कार्बन का एक 2s कक्षक और दो p-कक्षकें संकरित होकर तीन sp2-संकरित कक्षकों का निर्माण करती हैं, जो एक ही तल में रहते हैं। इसमें दो संकरित कक्षकें दो हाइड्रोजन परमाणु के 1s कक्षकों के साथ एक-रैखिक अतिव्यापन करके दो सिग्मा (σ) बन्ध बनाते हैं तथा तीसरा संकरित कक्षक C_C के बीच रैखिक अतिव्यापन से एक सिग्मा (σ) बन्ध बनाने में प्रयुक्त होता है। दोनों कार्बन परमाणुओं का एक-एक pz, कक्षक अभी भी अर्द्धपूर्ण ही रहता है तथा असंकरित होता है, जो पार्श्व अतिव्यापन करके पाई (π) बन्ध बनाता है। इस प्रकार एथिलीन में कार्बन के दोनों परमाणुओं के बीच एक सिग्मा (σ) एवं एक पाई (π) बन्ध होता है

(iii) sp:-संकरण- जब एक परमाणु की बाह्यतम कक्ष की आधी भरी एक s तथा तीन p-कक्षके परस्पर मिश्रित होकर चार नई समान कक्षकों का निर्माण करती हैं तो इस प्रकार की संकरित कक्षको को sp3-संकरित कक्षक कहते हैं तथा इस संकरण को sp3 -संकरण कहते हैं।

ये sp3 -संकरित कक्षकें परस्पर समचतुष्फलक के रूप में बँधी रहती हैं तथा इनमें बन्धों के बीच का कोण 109°28′ का होता है
(1) मेथेन की संरचना— इसमें कार्बन परमाणु की मूल अवस्था में केवल दो अय इलेक्ट्रॉन होते हैं, जो केवल दो सहसंयोजक बन्ध बना सकते हैं, परन्तु उत्तेजित अव में इसमें चार अयुग्मित इलेक्ट्रॉन हो जाते हैं (1s2,2s1-2p1x, 2p1y 2p1z) इसमें एक | तथा तीन -कक्षकें संकरित होकर चार नई sp3-संकरित कक्षकों का निर्माण करती हैं। कक्षकें चार हाइड्रोजन परमाणुओं की चार अर्द्धपूर्ण -कक्षकों से अपने अक्षों पर अतिव्यापन सहसंयोजी बन्ध बना सकती हैं जो sp3-संकरण द्वारा समान शक्ति के होते हैं। इस प्रकार मे के अणु का निर्माण होता है जिसका आकार समचतुष्फलकीय होता है।

इसमें कार्बन के संकरण से sp3-संकर कक्षकें बनती हैं। ये चतुष्फलक के चारों किनारे पर केन्द्रित रहती हैं तथा ये चारों कक्षकें आपस में 109°28′ का कोण बनाती हैं। ये कोण इसलिए अधिक होता है क्योंकि कक्षकों के इलेक्ट्रॉन आपस में प्रतिकर्षण करते हैं और इसलिए ये इतनी दूर रहते हैं जितनी दूर सम्भवतः ये रह सकते हैं। ये चार हाइड्रोजन परमाणु की चार आधी भरी s-कक्षकों से अपने अक्षों पर अतिव्यापन से चार σ-बन्धों का निर्माण करते हैं। इनमें से प्रत्येक बन्ध पूर्णतया तुल्य होता है और इनकी सामर्थ्य तथा लम्बाई भी समान होती है। .
(2) इसी प्रकार CCl4 अणु का आकार भी चतुष्फलकीय होगा जिसमें कार्बन परमाणु चतुष्फलक के केन्द्र पर तथा चारों क्लोरीन परमाणु 109°28′ के कोण बनाते हुए चारों कोन पर होते हैं।
प्रश्न 4. निम्नलिखित में से किन्हीं तीन पर संक्षिप्त टिप्पणियाँ लिखिए
- कार्बोनियम आयन या कार्बोकैटायन,
- नाइट्रीन –
III. कार्बीन ।
- कार्बेनायन अथवा कार्बीन्स की संरचना एवं बनाने की विधियाँ लिखिए।
उत्तर : I. कार्बोनियम आयन या कार्बोकैटायन (कार्बधनायन)
वह आयन जिसमें एक कार्बन परमाणु धनावेशित होता है कार्बोनियम आयन या कार्बोकैटायन कहलाता है। कार्बोनियम आयन किसी कार्बनिक समूह (B) तथा अधिक विद्युत ऋणी परमाणु (X) के मध्य सहसंयोजी आबन्ध के विषमांगी विदलन से बनता है |

मेथिल कार्बोकैटायन कार्बोकैटायनों की विशेषताएँ—कार्बोकैटायनों की प्रमुख विशेषताएँ निम्न प्रकार हैं
(i) कार्बोकैटायन में धनावेशित कार्बन परमाणु के संयोजी कोश में छ: इलेक्ट्रॉन रह जाते हैं जिससे इनमें इलेक्ट्रॉनों की कमी आ जाती है।
(ii) यह अस्थायी व अति क्रियाशील होते हैं तथा अभिक्रियाओं में मध्यवर्ती के रूप में । बनते हैं।
(iii) यह नाभिकस्नेही अभिकर्मकों से अभिक्रिया करते हैं जिससे इनका अष्टक पूरा हो जाता है।

(iv) ये ध्रुवीय विलायकों के विलयन में विलायकयोजित आयन (solvated ion) के रूप में रह सकते हैं तथा अध्रुवीय विलायकों में आयन युग्म के रूप में रह सकते हैं। आयन युग्म का अर्थ है जो पास के ऋणायन से जुड़ा हो; जैसे—

(v) इलेक्ट्रॉन आकर्षी समूहों (जैसे—NO2,-COOH) से जुड़े होने पर इनकी क्रियाशीलता बढ़ जाती है व स्थायित्व कम हो जाता है। इसके विपरीत इलेक्ट्रॉन प्रतिकर्षी समूहों (जसे-ऐल्किल समूह) से जड़े होने पर इनकी क्रियाशीलता कम हो जाती है व स्थायित्व बढ़ जाता है।
(vi) इनके नाम उपस्थित ऐल्किल समूह के नाम में कार्बोकैटायन जोड़ने से प्राप्त होते हैं जैसे CH3 का नाम मेथिल कार्बोकैटायन है।
कार्बोकैटायनों का वर्गीकरण
कार्बोकैटायनों को उनकी धनावेशित कार्बन की प्रकृति के आधार पर निम्न प्रकार वर्गीकृत किया गया है- .
(i) प्राथमिक (19) कार्बोकैटायन– वे कार्बोकैटायन जिसमें धनावेशित कार्बन की केवल एक संयोजकता अन्य किसी कार्बन व शेष दो संयोजकताएँ दो हाइड्रोजन परमाणुओं से जुड़ी होती हैं, प्राथमिक (1°) कार्बोकैटायन कहलाते हैं; जैसे—RC+H2, आयन, C+H3 आयन, CH3-C+H2, आयन आदि।

मेथिल कैटायन जिस पर केवल तीन हाइड्रोजन परमाणु होते हैं (कोई अन्य कार्बन नहीं जुड़ा होता है) को भी प्राथमिक कार्बोकैटायन के तुल्य ही माना जाता है।
(ii) द्वितीयक (2°) कार्बोकैटायन- वे कार्बोकैटायन जिनके धनावेशित कार्बन की दो संयोजकताएँ अलग-अलग अन्य कार्बन परमाणुओं से व शेष एक संयोजकता हाइड्रोजन परमाणु से जुड़ी होती है, द्वितीयक (2°) कार्बोकैटायन कहलाते हैं; जैसे—R2C+ आयन, (CH3)3C+ आयन आदि।

(iii) तृतीयक (3°) कार्बोकैटायन- वे कार्बोकैटायन जिनके धनावेशित कार्बन के तीनों संयोजकताएँ अलग-अलग तीन अन्य कार्बन परमाणुओं से जुड़ी होती हैं तथा को हाइड्रोजन परमाणु जुड़ा नहीं होता, तृतीयक (3°) कार्बोकैटायन कहलाते हैं; जैसे—R3C+ आयन, (CH3)3C+ आयन।

कार्बोकैटायन का बनना- कार्बोकैटायन अभिक्रियाओं में मध्यवर्ती के रूप में बनते हैं | ऐसी ही कुछ अभिक्रियाएँ निम्न प्रकार हैं
- असंतृप्त यौगिकों पर अम्लों की योगात्मक अभिक्रिया द्वारा- जब असर यौगिक की प्रोटानिक अम्ल से अभिक्रिया करायी जाती है तो कार्बोनियम आयन बनता है।
-
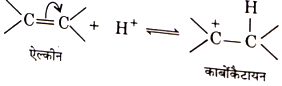
BSC Organic Chemistry Hybridization Benzene free radical Notes - असंतृप्त यौगिकों पर हैलोजेन की अभिक्रिया द्वारा- असंतृप्त यौगिक जब नों (जैसे—Cl2,Br आदि) से क्रिया करते हैं तो कार्बोकैटायन बनते हैं।

- तृतीयक ऐल्किल हैलाइडों के जल-अपघटन में- तृतीयक ऐल्किल हैलाइड जब तनु अम्लों द्वारा जल-अपघटित किए जाते हैं तो कार्बोकैटायन बनते हैं।

कार्बोकैटायन का स्थायित्व- कार्बोकैटायनों का स्थायित्व धनावेशित कार्बन परमाणु से जुड़े परमाणु या समूहों की प्रकृति व उनके प्रेरणिक प्रभाव, अनुनाद व अतिसंयुग्मन प्रभाव आदि पर निर्भर करता है।
जब धनावेशित कार्बन से जुड़े ऐल्किल समूह इलेक्ट्रॉन प्रतिकर्षी (+I प्रभाव) होते हैं तो धनावेश के विसर्जन व उदासीनीकरण के कारण कार्बोकैटायन का स्थायित्व बढ़ जाता है। इसी कारण ऐल्किल समूहों की संख्या बढ़ने के साथ कार्बोकैटायनों का स्थायित्व बढ़ता जाता है।

अर्थात् इनके स्थायित्व का क्रम 3° कार्बोकैटायन >2° कार्बोकैटायन >
इसके विपरीत जब धनावेशित कार्बन से इलेक्ट्रॉन आकर्षी (-1) प्रभाव वाले समूह (जैसे— —NO2,—COX
स्थायित्व बढ़ते क्रम में आदि) जुड़े होते हैं तो धनावेश बढ़ जाने के कारण कार्बोकैटायन’ जाता है ऐलिल, बेन्जिल, ट्राइफेनिलमेथिल आदि कार्बोकैटायनों में स्थायित्व अनुनाद(resonance) । के द्वारा समझाया जा सकता है इन कैटायनों में धनावेश अनुनाद के कारण (localised) न रहकर अन्य परमाणुओं पर विस्थापित हो जाता है किसी कैटायन की अनुनादी सरंचना जितनी अधिक होगी वह उतना ही अधिक स्थायी होगा| जाता है। किसी कैटायन की अनुनादी संरचनाएँ जितनी अधिक होंगी वह उतना ही अनिस्थायी होगा।

इसी प्रकार कार्बोकैटायनों का स्थायित्व धनावेशित कार्बन से जुड़े कार्बन परमाणुओं पर हाइड्रोजन परमाणुओं की संख्या से भी स्पष्ट किया जा सकता है, जितने अधिक अतिसंयुग्मित हाइड्रोजन परमाणु होंगे, कार्बोकैटायन उतना ही अधिक स्थायी होगा। (CH3)3C+ में 9H, (CH3)2C+ में 9H, (CH3)2C+H, में 6, CH3 C+H2 में 3H तथा H3C+ में कोई अतिसंयुग्मित H न | होने के कारण इनके स्थायित्व का क्रम (CHF)3C>(CHg),CH > CH. CHp>Hg | होता है। विभिन्न प्रकार के कैटायनों के स्थायित्व का क्रम (CH3)3 C+>(CH3)2 C+H>CH3,C+H2,>H3C+

कार्बोकैटायन की संरचना– कार्बोकैटायन के धनावेशित कार्बन में तीन sp2-संकरित . कक्षक (orbital), तीन सिग्मा (0) आबन्ध बनाते हैं। यहाँ पर एक रिक्त (vacant) p-कक्षक तीनों -आबन्धों के तल (plane) के ऊपर तथा नीचे उपस्थित रहता है। इसी रिक्त p-कक्षक के कारण इस कार्बन पर इलेक्ट्रॉन की कमी हो जाती है तथा यह धनावेशित हो जाता है और इलक्ट्रान दाता क साथ सयुक्त हाकर.अपना अष्टक पर्ण कर लेता है (चित्र-17 संरचना समतल कोणीय (trigonal planar) होती है।

- नाइट्रीन
ये वे उदासीन एकसंयोजी नाइट्रोजन की स्पीशीज हैं जिनमें नाइट्रोजन परमाणु पर इलेक्ट्रॉनों के दो अयुग्मित युग्म एक, एकसंयोजी तत्व या समूह के साथ जुड़े होते हैं; . जैसे- σ−N:
इन्हें ऐजाइडों के ऊष्मीय-अपघटन द्वारा प्राप्त किया जाता है तथा ये कार्बीनों के समान ” अत्यधिक क्रियाशील होते हैं। –
सामान्यतः नाइट्रीन हुण्ड के नियम का पालन करती है। ये मूल अवस्था में ट्रिप्लेट होती है जिन पर दो अपभ्रंश sp कक्षक उपस्थित होते हैं। इस प्रत्येक कक्षक में एक इलेक्ट्रॉन उपस्थित होता है।

नाइट्रीन मध्यवर्ती द्वारा सम्पन्न होने वाली अभिक्रियाएँ—
- कर्टियस पुनर्विन्यास अभिक्रिया।
- श्मिट पुनर्विन्यास अभिक्रिया।
- हॉफमान ब्रोमेमाइड पुनर्विन्यास अभिक्रिया।
III. कार्बीन
कार्बीन बान अल्पकालिक उदासीन यौगिकों का एक वर्ग है जिनमें एक द्विसंयोजी कार्बन था दो अनाबन्धित इलेक्ट्रॉन होते हैं; जैसे- :CH2, :CCl2 आदि। कार्बीन अत्यधिक किर्यशील होते हैं तथा प्रबल इलेक्ट्रॉनस्नेही होते हैं क्योंकि इनकी प्रवृत्ति इलेक्ट्रॉन परमाणु तथा दो अनाबन्धित इल अत्यधिक क्रियाशील होते हैं तथा ‘युग्म ग्रहण करके अष्टक पूर्ण करने की होती है।
उदाहरणार्थ-
(i) मेथिलीन (:CH2)
(ii) फेनिल कार्बीन (C6H5-CH)
(ii) डाइऐल्किल कार्बीन (R2C)
(iv) डाइक्लोरो कार्बीन (:CCl2)
कार्बीन का निर्माण
कार्बीन निम्न प्रकार बनते हैं—
- क्लोरोफॉर्म पर ऐल्कोक्साइडों की अभिक्रिया से—

- पराबैंगनी किरणों की उपस्थिति में कीटोन या डाइऐजो मेथेन के अपघटन से—

कार्बीन के प्रकार
कार्बीन दो प्रकार के होते हैं—
- सिंगलेट कार्बीन- इसका कार्बन sp2-संकरित होता है। यह दो बन्धित इलेक्ट्रॉन युग्मों द्वारा दो परमाणुओं या समूहों से जुड़ा रहता है। एक sp2-संकरित कक्षक में एक एकाकी इलेक्ट्रॉन युग्म रहता है तथा असंकरित p-कक्षक रिक्त रहता है।

- ट्रिप्लेट कार्बीन— इसका कार्बन sp-संकरित अवस्था में होता है। इलेक्ट्रॉन युग्म इन दो sp-संकरित कक्षकों में होते हैं। इन्हीं कक्षकों के द्वारा यह परमाणुओं से जुड़ा रहता है। ऐसे कार्बन में दो असंकरित या शुद्ध कक्षक प्रत्येक में एक अयुग्मित इलेक्ट्रॉन रहता है। इन इलेक्ट्रॉनों के चक्रण एक ही दिशा में समान्तर होते है | प्रयोग द्वारा यह ज्ञात किया गया है कि अनेक कार्बीनों में अरेखीय (non-liner)चित्र रूप होता है
कर्बिनो के परमाणु को अपना अष्टक पूरा करने के लिए दो इलेक्ट्रॉनों की आवश्यकता। अत: ये इलेक्ट्रॉनस्नेही अभिकर्मक हैं। डाइहैलोकार्बीन्स तथा ऐसी कार्बीन्स जिनमें ” दिसंयोजी, ऑक्सीजन, सल्फर आदि से बन्धित हो तो प्राय: ये एकक रूप (सिंगलेटरूप) में होती हैं।
- कार्बेनायन
वह आयन जिसका एक कार्बन परमाणु ऋणावेशित होता है कार्बेनायन कहलाता है। कार्बेनायन किसी कार्बनिक समूह (R) तथा कार्बन से कम विद्युत ऋणी (जैसे-H या धातु M) परमाणु के मध्य सहसंयोजी आबन्ध के विषम विदलन से बनता है।

कार्बेनायनों की विशेषताएँ—काबेनायनों की प्रमुख विशेषताएँ निम्न प्रकार हैं
(i) कार्बेनायन में कार्बन के संयोजी कोश में एकाकी इलेक्ट्रॉन युग्म सहित 8 इलेक्ट्रॉन होते हैं जिससे इनमें ऋणावेश आ जाता है। इनकी ऑक्सीकरण संख्या -1 होती है।
(ii) ऋणावेश के कारण यह स्थायी एवं अतिक्रियाशील होते हैं।
(iii) ये अभिक्रियाओं में मध्यवर्ती के रूप में बनते हैं।
(iv) इनके नाम साधारण रूप में होते हैं, अर्थात् मूल ऐल्किल समूह के अन्त में कार्बेनायन लिखा जाता है; जैसे

(v) यह इलेक्ट्रॉनस्नेही (electrophiles) अभिकर्मकों से अभिक्रिया कर यौगिकों में परिवर्तित हो जाते हैं।
(vi) ऋणावेशित होने के कारण इलेक्ट्रॉन आकर्षी समूहों (जैसे NO2,>C=0,-CN आदि) से जुड़े होने पर इनका स्थायित्व बढ़ता है क्योंकि इन समूहों से कार्बन परमाणु पर ऋणावेश की कमी आ जाती है। इसके विपरीत, इलेक्ट्रॉन प्रतिकर्षी (जैसे-ऐल्किल R) समूह से जुड़े होने पर ऋणावेश में वृद्धि हो जाने के कारण इनका स्थायित्व कम हो जाता है।
कार्बनायनों का वर्गीकरण
कार्बोकैटायनों की भाँति इन्हें भी ऋणावेशित कार्बन की प्रकृति के अनुसार प्राथमिक, द्वितीयक तथा तृतीयक कार्बनायनों में वर्गीकृत किया जा सकता है।
- प्राथमिक (19) कार्बेनायन-वे कार्बेनायन जिनके ऋणावेशित कार्बन की केवल एक सयोजकता किसी अन्य कार्बन से व शेष दो संयोजकताएँ दो H परमाणुओं से जुड़ी होती हैं, प्राथमिक (1°) कार्बनायन कहलाते हैं; जैसे—

मेथिल कार्बेनायन (1° कार्बेनायन) मेथिल कार्बेनायन जिस पर केवल 3H परमाणु होते हैं (कोई अन्य कार्बन नहीं जुड़ा होता) उसे भी प्राथमिक कार्बेनायन के तुल्य माना जाता है।
(ii) द्वितीयक (2°) कार्बेनायन- वे कार्बेनायन जिनके ऋणावेशित कार्बन की दो संयोजकताएँ अलग-अलग अन्य कार्बन परमाणुओं से व शेष एक संयोजकता H परमाणु से Mal जुड़ी होती है, द्वितीयक (2°) कार्बेनायन कहलाते हैं; जैसे—

(iii) तृतीयक (3°) कार्बेनायन- वे कार्बेनायन जिनके ऋणावेशित कार्बन की तीनों संयोजकताएँ अलग-अलग तीन अन्य कार्बन परमाणुओं से जुड़ी होती हैं तथा कोई हाइड्रोजन परमाणु जुड़ा नहीं होता, तृतीयक (3°) कार्बेनायन कहलाते हैं; जैसे/

कार्बेनायनों का निर्माण— कार्बेनायन, अभिक्रियाओं में मध्यवर्ती के रूप में बनते हैं। ऐसी ही कुछ अभिक्रियाएँ निम्न प्रकार हैं
- कार्बधात्विक यौगिकों की अभिक्रियाओं में कार्बधात्विक यौगिकों की अभिक्रियाओं में कार्बन-धातु बन्ध (C-M) विखण्डित होकर कार्बेनायन बनाता है। ग्रिगनार्ड अभिकर्मक की क्रियाओं में कार्बेनायन मध्यवर्ती के रूप में बनते हैं।

- ट्राइफेनिल मेथेन पर क्षारों की अभिक्रिया द्वारा— टाइफेनिल मेथेन क्षारी से अभिक्रिया कर कार्बेनायन बनाते हैं

BSC Organic Chemistry Hybridization Benzene free radical Notes - ऐल्डिहाइड की अम्ल-क्षार अभिक्रियाओं में- ऐल्फा हाइड्रोजन युक्त ऐल्डिहाइड क्षारो से क्रिया कर प्रोटॉन मुक्त कर कार्बेनायन बनाते है|

- कार्बेनायन मालिक अम्लों के विकार्बोक्सिलीकरण से सोडियम ऐसीटेट को सोडालाइम के साथ गर्म करने पर मेथिल कार्बेनायन बनता है जो कि हाइड्रोजन से जुड़कर मीथेन बना देता है

कार्बेनायन कार्बेनायनों का स्थायित्व—
कार्बेनायनों का स्थायित्व ऋणावेशित. एकल. इलेक्ट्रॉन युग्म वाले कार्बन परमाणु से जुड़े परमाणु या समूहों की प्रकृति, प्रेरणिक व अनुनाद प्रभाव आदि पर निर्भर करता है।
जब ऋणावेशित कार्बन से जुड़े समूह इलेक्ट्रॉन प्रतिकर्षी (+I प्रभाव) होते हैं (जैसे—मेथिल, आइसोप्रोपिल आदि) तो ऋणावेश के बढ़ जाने के कारण कार्बेनायनों का स्थायित्व घट जाता है। इसके विपरीत, जब जुड़े हुए समूह इलेक्ट्रॉन आकर्षी (-I प्रभाव) होते हैं (जैसे—NO2,—CN, CHO) तो ऋणावेश के घट जाने व विसर्जित हो जाने के कारण काइँनायनों का स्थायित्व बढ़ जाता है।

बेन्जिल साइक्लोपेन्टाडाइएनिल आदि ऐनायनों (ऋणायनों) जिनमें ऋणावेशित कार्बन π- आबन्धो
होता है के स्थायित्व को अननाद के द्वारा समझाया जा सकता है।

डाइफेनिल मेथिल ऐनायन व ट्राइफेनिल मेथिल ऐनायन अधिक अनुनाद सरचना के कारण और अधिक स्थायी हो जाते हैं (अजलीय विलयनों में ये बहुत समय तक रखे जा सकते हैं)।

कार्बेनायन की संरचना- कार्बेनायन का ऋणावेशित कार्बन sp3-संकरित होता है। इसमें एकाकी इलेक्ट्रॉन युग्म उपस्थित होने के कारण इसकी ज्यामिति अमोनिया की भाँति पिरामिडीय आकार की होती है। वे कार्बेनायन जिनका स्थायित्व ऋणावेश के अनुनाद द्वारा विस्थापित होने के कारण होता है उनकी ज्यामिति निश्चित ही समतलीय (planar) होती है। इनमें आबन्ध कोण लगभग 107° होता है

प्रश्न 5. निम्नलिखित पर टिप्पणी लिखिए|
- मुक्त मूलक II. बेन्जाइन
उत्तर : I. मुक्त मूलक
सहसंयोजी आबन्ध के सम विदलन के फलस्वरूप बने अयुग्मित इलेक्ट्रॉन वाले अधिक क्रियाशील व अनुचुम्बकीय (paramagnetic). परमाणु (या समूह) मुक्त मूलक कहलाते हैं, अर्थात् विद्युत उदासीन परमाणु या परमाणुओं का समूह जिसके ऊपर विषम (odd) इलेक्ट्रॉन या अयुग्मित इलेक्ट्रॉन (unpaired electron) उपस्थित होता है, उसे ‘मुक्त मूलक’ कहते हैं।

मुक्त मूलकों की विशेषताएँ-मुक्त मूलकों की प्रमुख विशेषताएँ निम्न प्रकार हैं—
(i) यह सामान्यतः अस्थायी व अति क्रियाशील होते हैं क्योंकि इनकी ऊर्जा अधिक होती है।
(ii) कार्बनिक अभिक्रियाओं में ये क्रियाशील मध्यवर्ती के रूप में बनते हैं।
(iii) ये अन्य मूलकों से अभिक्रिया कर स्थायी युग्म आबन्ध बनाते हैं तथा अणु अभिक्रिया कर उन्हें मूलकों में परिवर्तित कर देते हैं और स्वयं अणु में परिवर्तित हो जाता है
(iv) अयुग्मित इलेक्ट्रॉन के कारण ये अनुचुम्बकीय (paramagnetic) होते है |
(v) विषम इलेक्ट्रॉनी होने के कारण ये विद्युत उदासीन होते है क्षणिक होता है। और इनका जीवनकाल क्षणक होता है
मुक्त मूलकों का वर्गी वर्गीकृत— स्थायित्व के आधार पर मुक्त मूलकों को दो वर्गों में वर्गीकर्त किया गया है— (i) दीर्घ आयु वाले (या स्थायी), जैसे—ट्राइफेनिल मेथिल मूलक तथा (ii) अल्प आयु वाले (या क्षणिक स्थायित्व), जैसे—मेथिल, एथिल आदि मूलक।
मुक्त मुलको के बनाने की विधिया
1.गोम्बर्ग की विधि— इस विधि से ट्राइफेनिल मेथिल मूलक का निर्माण गोम्बर्ग ने 11900 में ट्राइफेनिल मेथिल क्लोराइड को बेन्जीन में लेकर सिल्वर चूर्ण या जिंक धूल के साथ कई दिनों तक रखकर किया था।

- प्रकाशिक रासायनिक विघटन— ऐसीटोन की वाष्प पर 100°C पर जब प्रकाश की चमक डाली जाती है तो मुक्त मूलक बनते हैं।
 BSC Organic Chemistry Hybridization Benzene free radical Notes
BSC Organic Chemistry Hybridization Benzene free radical Notes - ऐजो तथा डाइऐजो यौगिकों के तापीय अपघटन द्वारा- ऐजो व डाइऐजो मेथेन के तापीय अपघटन से मुक्त मूलक बनते हैं।

मुक्त मूलकों का स्थायित्व- दीर्घ आयु वाले मुक्त मूलकों का स्थायित्व जैसे ट्राइफेनिल मेथिल मूलकों का स्थायित्व अनुनाद तथा त्रिविमबाधा’ (steric hindrance) के आधार पर समझाया जा सकता है, जबकि अल्प आयु वाले मूलकों जैसे मेथिल, एथिल आदि का स्थायित्व अतिसंयग्मन (hyperconjugation) द्वारा समझाया जा सकता है। इनका अनुनाद के कारण स्थायित्व बढ़ता है। अतः मुक्त मूलक का स्थायित्व अनुनादी संरचनाओं की संख्या के समानुपाती होता है। इनका स्थायित्व क्रम
(C6H5)3C > (C6H5)2CH>C6H5CH2, > CH2,=CH – CH2, होता है। मेथिल, प्राथमिक, द्वितीयक, तृतीयक मूलकों के स्थायित्व का क्रम + I प्रभाव बढ़ने पर बढ़ता है—

स्थायित्व के इस क्रम को अतिसंयुग्मन प्रभाव द्वारा सरलता से समझाया जा सकता है। अतः मूलक में σ-हाइड्रोजनों की संख्या जितनी अधिक होगी, उतना ही ‘वह अयुग्मित इलेक्ट्रॉन से साझा कर स्थायित्व प्रदान करेगा।
जबकि – I प्रभाव के कारण मुक्त मूलकों का स्थायित्व कम हो जाता है, जैसे—Cl-CH2, <CH3, में |

मक्त मलको की संरचना– असंतृप्त मुक्त मूलक समतलीय व sp2-संकरित होते हैं। तीन sp2-संकरित कक्षक एक तल में 120° पर व्यवस्थित होते हैं। ये तीन sp2-कक्षक हाइड्रोजन या अन्य परमाणुओं या समूहों के साथ σ-आबन्ध बनाते हैं।
नोट-सेतु वाले मुक्त मूलक (जैसे—CF3) असमतलीय/पिरामिडीय होते हैं। इनमें कार्बन परमाणु sp3-संकरित होता है तथा कार्बन परमाणु पर आबन्ध कोण 107° होता है।
मुक्त मूलकों की अभिक्रियाएँ- मुक्त मूलक प्राय: इतने अधिक क्रियाशील होते हैं कि इन्हें निष्कर्षित नहीं किया जा सकता बल्कि क्रियाशील मध्यवर्ती के रूप में पहचाना जा सकता है।
मुक्त मूलकों की अभिक्रियाएँ निम्नलिखित तीन पदों में पूर्ण होती हैं
- प्रारम्भन (Initiation),
- प्रगमन (Propagation),
- समापन (Termination):
(i) प्रारम्भन— इस पद में मुक्त मूलक बनते हैं इसे शृंखला का प्रारम्भन कहते हैं।

(ii) प्रगमन- इस पद में प्रथम पद में बना मूलक क्रियाकारी पदार्थ के अणु से क्रिया कर स्वयं अणु में परिवर्तित होकर नया मुक्त मूलक उत्पन्न करता है तथा इस प्रकार क्रिया तब तक चलती रहती है जब तक कि समस्त क्रियाकारी अणु समाप्त न हो जाएँ।

(iii) समापन- इस पद में समस्त मूलक आपस में विभिन्न मूलका स्वत: डाइमरीकरण (द्वितयन) द्वारा अणओं में परिवर्तित हो जाता है

मुक्त मूलकों की कुछ अन्य प्रमुख अभिक्रियाएँ निम्न प्रकार हैं—
(a) ऐल्केनों का क्लोरीनीकरण (b) ऐल्केनों का तापीय अपघटन (c) वुट्रज अभिक्रिया (d) एण्टीमार्कोनीकॉफ नियम (e) कोल्बे विद्युत अपघटनी संश्लेषण (f) बहुलकीकरण
अभिक्रिया।
मुक्त मूलकों की पहचान- मुक्त मूलकों की पहचान ESR (इलेक्ट्रॉन स्पिन रेजोनेन्स), चुम्बकीय सुग्राहिता (magnetic susceptibility), U.V. visible स्पेक्ट्रोस्कोपी या कलरमिति (colourimetry) से की जा सकती है।
बेन्जाइन या ऐरीन्स
1, 2-डाइडिहाइड्रो बेन्जीन (C6H4) और इसके व्युत्पन्न को बेन्जाइन या ऐरीन्स कहते हैं। ये ऐरोमैटिक यौगिकों की नाभिकस्नेही प्रतिस्थापन अभिक्रियाओं में माध्यमिक यौगिक के रूप में बनते हैं। इन यौगिकों में फार्मल C-C त्रिबन्ध होता है, इसलिए इन यौगिकों को . ऐसीटिलीन की तरह माना जाता है। अत: बेन्जाइन की संरचना निम्न प्रकार है

बेन्जाइन की क्रियाशीलता- बेन्जाइन (benzyne) यौगिकों में π-बन्ध sp2-ऑर्बिटलों से बनता है। यह श-बन्ध अत्यधिक अस्थायी होता है। π-बन्ध अस्थायी होने के कारण ये अत्यधिक क्रियाशील होते हैं।
बेन्जाइन का निर्माण- बेन्जाइन यौगिक अत्यधिक अस्थायी होते हैं। अत्यधिक अस्थायी होने के कारण ये यौगिक मुक्त अवस्था में प्राप्त नहीं किए जा सकते। इन यौगिकों को निम्नलिखित अभिक्रियाओं द्वारा प्राप्त किया जा सकता है। अभिक्रियाएँ इस प्रकार हैं—


ऐरीन्स का निर्माण कुछ अभिक्रियाओं में मध्यवर्ती (intermediate) के रूप में होता है।
बेन्जाइन की अभिक्रियाएँ—1. कुछ अभिकर्मकों के द्वारा बेन्जाइन का प्रग्रहण किया जा सकता है क्योंकि यह एक अस्थायी यौगिक है। अभिकर्मकों की अनुपस्थिति में बेन्जाइन द्विलकीकरण हो जाता है। इसकी अभिक्रिया इस प्रकार है—

- बेन्जाइन न्यूक्लिओफाइल के साथ अभिक्रिया करके योगात्मक अभिक्रिया देता है—

- बेन्जाइन ऐल्कीनों के साथ अभिक्रिया करके वलय बनाता है

बेन्जाइन की संरचना
बेन्जाइन की संरचना में त्रि-बन्ध ऐसीटिलीन के त्रि-बन्ध से भिन्न है। ऐसीटिलीन म sp-संकरित कार्बन के दो कक्षक दो सिग्मा बन्ध बनाते हैं तथा दो असंकरित p कक्षक π-बन्ध बनाते हैं। बेन्जीन रिंग षट्कोणीय होने के कारण इसमें ऐसा सम्भव नहीं है। 3 बेन्जीन में यह नया तीसरा π-बन्ध दो निकटवर्ती कार्बन परमाणुओं के sp2-संकरित कक्षका पार्श्व अतिव्यापन से बनता है जो ऐरोमैटिक वलय के π-अभ्र के तल के बाहर होता है। वलय के ऊपर व नीचे स्थित π-अभ्र के साथ अत्यन्त कम अन्योन्य क्रिया दर्शाता है। यह बात बेन्जीन वलय के π-आण्विक आर्बिटल के लम्बवत् होता है।
प्रश्न 6. बायर के विकृति सिद्धान्त से आप क्या समझते हैं? इसके लाभ, सीमाओं था इसमे किए गए सुधारों का वर्णन कीजिए।
अथवा बायर के विकृति सिद्धान्त तथा अनुप्रयोगों का वर्णन कीजिए। इस सिद्धान्त के दोष था इसमे किए गए संशोधनों की विवेचना कीजिए।
उतर: बायर का तनाव सिधान्त (विकति सिद्धान्त)
छोटे वलय यौगिक जैसे साइक्लोप्रोपेन तथा साइक्लोब्यूटेन की अभिक्रियाएँ । साइक्लोपेंन्टेन तथा साइक्लोहेक्सेन की अपेक्षाकृत अपवादयुक्त होती हैं। साइक्लोप्रोपेन तथा ,लोयटेन ऐल्कीन की भाँति, शीघ्रता से हैलोजेन, हैलोजेन अम्लों तथा हाइड्रोजन के साथ योग करके योग यौगिक देते हैं। इन अभिक्रियाओं में इनके वलय विखण्डित होकर विकृत श्रृंखला युक्त यौगिक देते हैं। इन अभिक्रियाओं से इनका असंतृप्त गुण स्पष्ट होता है।

जबकि साइकलोपिन्टेन तथा साइक्लोहेक्सेन उपर्युक्त अभिक्रियाएँ नहीं देने के ना की भाँति अत्यधिक स्थायी होते हैं। उच्च साइक्लोऐल्केनों के अधिक स्थायित्व म्न ऐल्केनों की अधिक सक्रियता व कम स्थ
का अधिक सक्रियता को समझने के लिए वैज्ञानिक बायर ने अपना विकृति का पादित किया, जिसको बायर का विकृति सिद्धान्त कहते हैं। इस सिद्धान्त के मुख्य बिन्दु निम्नवत् हैं
- कार्बन परमाणु की चारा संयोजकताएँ एक समचतुष्फलक (regular tetrahedron) के चारों कोनों की तरफ झुकी रहती हैं और कार्बन चतुष्फलक के केन्द्र पर स्थित रहता है। इसमें प्रत्येक दो संयोजकताओं के मध्य 109°28′ का कोण होता है। इसकी ली बेल-वाण्ट हॉफ परिकल्पना कहते हैं।
- कार्बन की संयोजकताएँ स्थिर (rigid) नहीं होती हैं (ली बेल तथा वाण्ट हॉफ की अभिधारणा के विपरीत) और उनकी दिशा (direction) को परिवर्तित कर सकते हैं। इस प्रकार का कोई भी परिवर्तन अणु में तनाव (विकृति) उत्पन्न करेगा और अणु को अस्थायी बनाएगा। सामान्य संयोजकता बन्धन कोण में इस प्रकार के विचलन (deviation) को बन्धन कोण तनाव (angle strain) कहते हैं। कोण तनाव की मात्रा वलय तन्त्र के स्थायित्व को प्रकट करती है।
- सामान्य संयोजकता बन्ध कोण (109°28′) से जितना अधिक विचलन होगा उतना ही अधिक उस अणु में तनाव होता है और उतना ही कम वह स्थायी होता है। यदि यह कोण तनाव 109°28′ से कम है तो इसको धनात्मक तनाव परन्तु यदि तनाव अधिक है तो इसको ऋणात्मक तनाव कहते हैं।
- किसी वलय के सभी कार्बन परमाणु सहतलीय (coplanar) होते हैं अर्थात् एक ही तल में होते हैं, अत: दो कार्बनों के मध्य का कोण चतुष्फलक कोण (tetrahedral angle)के समान नहीं होता है। . विभिन्न वलय तन्त्रों में बन्धन कोण का विचलन निम्न सम्बन्ध से ज्ञात किया जा सकता है

एथिलीन अणु को द्विभुजीय वलय मानते हुए इसका कोण 0° होगा। अतः कोण तनाव निम्न होगा—



उपर्युक्त से स्पष्ट है कि साइक्लोप्रोपेन में कोण तनाव का मान सबसे अधिक है, अतः ।। बराबर विकृति सिद्धान्तानुसार इसका वलय सबसे अधिक तनावयुक्त है और सबसे अधिक अस्थायी होता है। इसी कारण यह आसानी से वलय विखण्डन तथा योग अभिक्रियाएँ देता है। साइक्लोब्यूटेन में कोण तनाव का मान साइक्लोप्रोपेन से कम है, अत: इसकी वलय विखण्डन तथा योग क्रियाएँ साइक्लोप्रोपेन की अपेक्षाकृत कम तीव्रता से होती हैं। पाँच तथा छ: भुजीय वलय तन्त्रों में कोण तनावों का मान और भी कम है, अतः ये अधिक स्थायी होते हैं। बायर के समय में 7 या उससे अधिक कार्बन वाले वलय यौगिक ज्ञात नहीं थे।
बायर विकृति सिद्धान्त के पक्ष में अधिक प्रमाण
- कार्बन-कार्बन द्वि-बन्ध को द्विभुजीय वलय मानने से इसमें सबसे अधिक तनाव अर्थात् + 54.75° होगा, जो सभी साइक्लोऐल्केनों से अधिक है, यह बायर विकृति सिद्धान्त के पक्ष में है। अत: एथिलीन सबसे अधिक सक्रिय है और शीघ्रता से योग अभिक्रियाएँ देती है।
- साइक्लोप्रोपेन तथा साइक्लोब्यूटेन में प्रति – CH2– समूह दहन ऊष्मा (heat of combustion) के मान क्रमश: 166.6 तथा 164.0 kcal/ mol हैं। जबकि साइक्लोपेन्टेन तथा साइक्लोहेक्सेन के लिए ये मान समान क्रमश: 158.7 तथा 157.4kcal/mol हैं। ये मान विकृत श्रृंखला युक्त ऐल्केनों के प्रति – CH,- (157.4kcal/mol) के समान हैं। विभिन्न साइक्लोऐल्केनों की प्रति – CH2– दहन ऊष्मा के मान निम्नवत् हैं

चूँकि साइक्लोप्रोपेन तथा साइक्लोब्यूटेन की साइक्लोपेन्टेन, साइक्लोहेक्सेन या ऐल्ली की अपेक्षाकृत प्रति – CH2,- समूह ऊर्जा अधिक होती है। अत: ये साइक्लोपेन्टेन साइक्लोहेक्सेन से कम स्थायी होते हैं। यह अभिधारणा बायर विकृति सिद्धान्त के पक्ष जाती है। चूँकि उच्च वलय वाले साइक्लोऐल्केनों की दहन ऊष्मा ऐल्केनों के समान है, अतः अधिक स्थायी होते हैं।
बायर विकृति सिद्धान्त की सीमाएँ या बायर की विकृति सिद्धान्त के दोष
- चूँकि कार्बन-कार्बन द्वि-बन्ध में सबसे अधिक कोण तनाव (+ 54.75°) होता अत: इसको आसानी से प्राप्त नहीं किया जा सकता परन्तु ऐल्कीन यौगिक आसानी से प्राप्त हो जाते हैं, अत: यह बायर विकृति सिद्धान्त के अनुकूल नहीं है।
- बायर विकृति सिद्धान्त के आधार पर वलय का आकार बढ़ने से दहन ऊष्मा का मान प्रति – CH2,- अधिक होना चाहिए, जबकि साइक्लोहेप्टेन तथा साइक्लोब्यूटेन के कोण तनाव क्रमशः – 9.54 व + 9.54° हैं जो समान हैं, अतः दहन ऊष्मा का मान 164 kcal/mol होना चाहिए। यदि विकृति सिद्धान्त सही होता तो वलय का आकार बढ़ने से दहन ऊष्मा का मान उत्तरोत्तर बढ़ना चाहिए, परन्तु साइक्लोपेन्टेन तथा अन्य में इसका मान लगभग ऐल्केनों के समान होता है। यह तथ्य भी विकृति सिद्धान्त के अनुकूल नहीं है अर्थात् उच्च वलय तन्त्र अस्थायी होने चाहिए जबकि वे सभी अत्यधिक स्थायी होते हैं।
- विकृति सिद्धान्त के अनुसार छ: कार्बन से अधिक वाले वलय अस्थायी होने चाहिए और उनमें अधिक तनाव होने के कारण उनको उत्पन्न ही नहीं होना चाहिए। अब सिद्ध कर दिया गया है कि 6 कार्बन से अधिक वाले वलय भी उतने ही अधिक स्थायी हैं जितने कि विवृत श्रृंखला वाले ऐल्केन होते हैं। मस्कोन (muscone) तथा सिविटोन (civetone) में क्रमश: 16 व 17 कार्बन एक वलय के अन्दर होते हैं। रुजिका (Ruzicka) ने 34 कार्बन तक के वलय यौगिक प्राप्त करने की विधियाँ दीं।
बायर विकृति सिद्धान्त के अनुप्रयोग
- चक्रीय यौगिकों का सापेक्ष स्थायित्व- जिस यौगिक का कोण तनाव अधिक होगा, वही सबसे अधिक अस्थायी होगा। चूँकि एथिलीन में कोण तनाव (angle strain) का मान सबसे अधिक है, अत: यह सबसे कम स्थायी तथा अधिक सक्रिय है। साइक्लोपेन्टन, साइक्लोहेक्सेन में कोण कम होने के कारण ये अधिक स्थायी हैं और इसी कारण प्रकृ’ बहुतायत में पाए जाते हैं।
- चक्रीय यौगिक बनने की सरलता- साइक्लोपेन्टेन तथा साइक्लोहक्सन सरलता से प्राप्त होते हैं, इसके पक्ष में निम्न प्रमाण हैं
(a) केवल 1, 4 तथा 1, 5-द्विकार्बोक्सिलिक अम्ल ही शीघ्रता से जल । चक्रीय ऐनहाइड्राइड बनाते हैं।
(b) केवल γ- तथा δ-हाइड्रॉक्सी यौगिक ही शीघ्रता से लैक्टोन बनाते हैं—
बायर सिद्धान्त का रूपान्तरण या साचे तथा मोहर का तनावमुक्त चक्रीय यौगिक का सिद्धान्त– बायर विकृति सिद्धान्त की कमियों को दूर करने के लिए मोहर तथा साचे ने अपना तनावमुक्त चक्रीय यौगिक सिद्धान्त दिया जिसको साचे-मोहर सिद्धान्त कहते हैं। इस सिद्धान्त के अनुसार 5-चक्रीय तथा निम्न चक्रीय यौगिकों में सभी कार्बन एक ही तल में हो सकते हैं, परन्तु साइक्लोहेक्सेन तथा उच्च चक्रीय यौगिकों में ये कार्बन परमाणु भिन्न-भिन्न तलों में उपस्थित रहते हैं। अत: कोण तनाव का मान जो बायर अभिधारणा से ज्ञात किया गया है, उचित नहीं है। अत: साइक्लोहेक्सेन में सभी कार्बन परमाणु सिकुड़ी (pickered) व्यवस्था के द्वारा समचतुष्फलकीय संयोजकता कोण धारण कर लेते हैं। अतः इसके अणु में कोई तनाव (विकृति) नहीं होता है। इस प्रकार की सिकुड़ी तनावमुक्त अतलीय संरचनाएँ उतनी . ही स्थायी होंगी जितने विवृत श्रृंखला वाले ऐल्केन होते हैं।
साचे तथा मोहर के विकृतिहीन या तनावमुक्त वलय सिद्धान्त (strainless ring theory) के अनुसार साइक्लोहेक्सेन दो अतलीय सिकुड़े संरूपणों में उपस्थित रहता है। ये दोनों रूप कोण तनाव से पूर्णतया मुक्त होते हैं। साइक्लोहेक्सेन के इन दो संरूपणों को आकार के आधार पर कुर्सी रूप (chair form) या Z-संरूपण तथा नावरूप (boat form) या C-संरूपण कहते हैं। साइक्लोहेक्सेन के इन दोनों रूपों में वलय कार्बनों का संयोजकता कोण 109°28′ होता है तथा इनको निम्नांकित चित्रों में प्रदर्शित किया गया है—

कुर्सी तथा नाव रूप परस्पर एक-दूसरे में चलायमान रहते हैं। इन दोनों रूपों का अन्तरारूपान्तरण कार्बन बन्धों के चारों तरफ घूर्णन से होता है क्योंकि जिन माध्यमिक संरूपणों के बीच से अणु गुजरता है, वे विकृत तथा कम स्थायी होते हैं।

उपयुकक्त रूपान्तरण में की तथा नाव रूप दो अन्तिम रूप हैं, इन दोनों संरूपणों के मध्य “धका होती है यद्यपि इसका मान बहुत कम होता है। साइक्लोहेक्सेन का कुर्सी रूप, नाव रूप से अधिक स्थायी होता है। साधारण परिस्थितियों में साइक्लोहेक्सेना अधिकतम अणु कुर्सी रूप में ही रहते हैं।

कुर्सी रूप में सभी हाइड्रोजन परमाणु दो प्रकार के होते हैं। इनमें से छह हाइड्रोजन परमाणु ऊपर की तरफ को या नीचे की तरफ को झुके रहते हैं, इनको अक्षीय (axial) हाइड्रोजन (Ha) कहते हैं जबकि अन्य छह हाइड्रोजन परमाणु तल के थोड़ा ऊपर या नीचे रहते हैं, इनको भूमध्य (equatorial) हाइड्रोजन (He) कहते हैं।
साइक्लोहेक्सेन के विभिन्न संरूपणों की आपेक्षिक ऊर्जाएँ निम्नांकित चित्र-26 में | दिखायी गई हैं—

उपर्युक्त ऊर्जा चित्र से स्पष्ट होता है कि कुर्सी रूप (I) में नाव रूप (IV) 6.9 kcal/mol कम ऊर्जा होती है, जबकि आधी कुर्सी रूप (II) में सबसे आधक (11 keal/mol) होती है, अत: यह सबसे कम स्थायी होती है। किसी भी क्षण, आ साइक्लोहेक्सेन अणु कुर्सी रूप में विद्यमान रहते हैं। वास्तव में, साइक्लोहेक्सेन के 99.9% अणु कुर्सी संरूपण में ही रहते हैं। कुर्सी रूप की कम ऊर्जा के कारण यह अधिक स्थिति होत्ती है |
Inorganic Chemistry
|
|
||||||

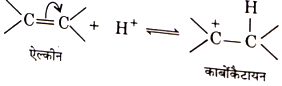

 BSC Organic Chemistry Hybridization Benzene free radical Notes
BSC Organic Chemistry Hybridization Benzene free radical Notes