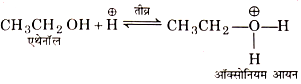B Sc Organic chemistry Unit 1st Notes
B Sc Organic chemistry Unit 1st Note:-
Unit 1st
1. सहयोजक बन्ध (कोवैलेंट आबन्ध ) का समांश एव विषमाश विखण्डन क्या है
उत्तर : सहयोजी आबनधो का विदलन या विखंडन
कार्बनिक अभिक्रिया में परमाणुओं के मध्य बने सहसयोजी आबन्ध टूटते व् बनते रहते है सहसयोजी आबन्धो (बन्धो) का यह विदलन दो प्रकार का हो सकता है-
- सम विदलन ,
- विषम विदलन |
1.सम (समाश) विदलन या होमोलिटिक विदलन
जब सहसयोजी आबन्ध A-B के A तथा B परमाणु साझे के इलेक्ट्रोन युग्म से एक-एक इलेक्ट्रोन लेकर प्रथक हो जाते है तो आबन्ध के इस प्रकार के सममित रूप से विदलन को सम अथवा होमोलिटिक अथवा समाश विदलन या विखण्डन कहते है |

होमोलिटिक विदलन की निम्नलिखित विशेषताए है-
- इस प्रकार के विदलन से मुक्त मुलक (या अयुग्मित इलेक्ट्रोन अणु) बनते है |
यह विदलन प्राय: गैसीय अवस्था वाली अभिक्रियाओं में होता है |
- यह विदलन प्राय: पराबैगनी प्रकाश, उच्च ताप या कार्बनिक पराक्साइड द्वारा प्रेरित किया जाता है |
- अधुर्वीय विलायको (non-polar solvent) में अधुर्वीय योगिको का विदलन प्राय: होमोलिसिस (homolysis) से ही होता है |
उद्धरण-


विषम (विषमाश) विदलन या हेटरोलिटिक विदलन
जब सहसयोजी आबन्ध (A-B) असममित रूप से इस प्रकार विदलित हो की इलेक्ट्रॉनक योग्म किसी एक परमाणु A अथवा B के साथ रह जाए तो इस प्रकार के विदलन को हेटरोलिटिक या विषमाश या विषम विदलन कहते है |

हेटरोलिटिक विदलन की निम्नलिखित विशेषताए है-
(i) इस प्रकार के विदलंन से विपरीत आवेश वाले आयन बनते है |अधिक विधुत ऋणात्मकता वाले परमाणु पर इलेक्ट्रान युग्म बढ़ जाने के कारण ऋणावेश होता है तथा कम विधुत ऋणात्मक वाले परमाणु पर इलेक्ट्रान की कमी के कारण धनावेश होता है |
(ii) यह विदलन सामान्यत: विलयन में होता है व विदलन की दर विलयन की प्रक्रति पर निर्भर करती है |
(iii) यह विदलन धुर्वीय विलायको की उपस्थिति में सुगमता से होता है |
(iv) इस विदलन के फलस्वरूप होने वाली अभिकिर्याए धुर्वीय विलायको तथा आयनी उत्प्रेरक द्वारा प्रेरित होती है |
उदाहरणार्थ—

Q. 2. बंध उर्जा क्या है ? इसे प्रभावित करने वाले कारको का वर्णन कीजिए |
अथवा बन्ध उर्जा पर संक्षिप्त टिप्पणी लिखिए |
उतर : बन्ध उर्जा
एक दुसरे से अनंत दुरी पर स्थित दो परमाणुओं को पास लाकर बन्ध बनाने में जीती उर्जा मुक्त होती है उसे बन्ध उर्जा कहते है दुसरे शब्दों में, किसी बन्ध को तोडकर परमाणुओं को पूर्णत: प्रथक करने के लिए आवश्यक उर्जा बन्ध वियोजन उर्जा (bond dissociation energy ) कहलाती है |
द्रि-परमाण्विक अणु के लिए दोनों प्रकार की उर्जाओ के मान समान होते है| बहू-परमाणुक अणु में ऐसा नही होता | जैसे CH2 में यदि चारो C-H बन्धो को क्रमश: तोडा जाए तो बन्ध वियोजन उर्जाओ के मान निम्न प्रकार होगे—

बन्ध उर्जा को अणुओ की दहन उर्जाओ से ज्ञात किया जाता है| बन्ध उर्जा आबिर्ल्ट अतिव्यापन विस्तार पर भी निर्भर करती है | अतिव्यापन जितना अधिक होगा बन्ध उतना ही प्रबल होगा |
बन्ध उर्जा निम्न कारको पर निर्भर करती है—
- बन्ध की धुर्वीयता— बन्ध की धुर्वीयता बढ़ाने पर बन्ध उर्जा का मान बढ़ता है जबकि बन्ध की धुर्वीयता बन्धित परमाणुओं की विधुत ऋणात्मकता का अन्तर
उदाहरणार्थ, हैलोजेन अम्लो (HCI, HBr, HI व HF) में
विधुत ऋणात्मकता के अन्तर का क्रम H—F > H—CI> H—Br > H—I
∴ बन्ध की धुर्वीयता का कर्म H—F> H—CI> H—Br> H—I
अत: बन्ध उर्जा का कर्म H—F> H—CI>H—Br> H—I
- परमाणविय आकार—परमाणु आकार बढने पर बन्ध उर्जा का मान घटता है, जैसे CI2 , Br2 व I2 में परमाणविय आकार का कर्म CI<Br<I है, अत: इनमे बन्ध उर्जा का कर्म CI2>Br2>I2 है |
- अनुनाद— अनुनाद के कारण अणु का स्थायित्व बढ़ता है; फलस्वरूप बन्ध उर्जा का मान भी बढ़ता है|
- परमाणुओ के सकरण के प्रकार— बन्ध उर्जा परमाणु के संकरण पर भी निर्भर करती है जैसे C2H6, C2H4 व C2H2 में कार्बन परमाणु क्रमशः sp3, sp2 व sp- संकरित है जिस कारण इनमे C—H बन्ध उर्जा का कर्म

- अतिव्यापन की मात्रा— अतिव्यापन प्रभावी होने पर बन्ध उर्जा का मान बढ़ता है |
- बन्ध कर्म— बन्ध कर्म बढने पर उर्जा का मन क्रमशः बढ़ता है जैसे एल्केन, एल्किन व एलकइन में बन्ध उर्जा का कर्म C—C < C = C < C = C है |
कुछ दिवपरमाणु और बहूपरमाणुक अणुओ में बन्ध वियोजन उर्जाओ के मान सरणी में दिए गए है |
बन्ध वियोजन उर्जा के मान (kJ mol-1) दिवपरमाणुक अणु के लिए

Q. 3. विस्थानीकरण को स्पष्ट रूप से समझाये |
अथवा विस्थानिकरण पर संक्षिप टिप्पणी दीजिए |
उतर : विथानीकरण
X-किरण विवर्तन अध्ययन (X-ray diffraction studies) के आधार पर स्पष्ट है की बेन्जीन का अणु समषटकोण तथा समतल है | इसके सभी छ: कार्बन परमाणु एक समषटकोणीय आकार में व्यवस्थित है तथा इनके बीच की दुरी 1.39A0 है | इसमे सभी H—C—C एव C—C—C आबन्ध कोण का मान 120O होता है | अत: बेन्जीन में सभी कार्बन परमाणु sp2 –सकरित अवस्था में होते है जिनके कारण प्रत्येक कार्बन पर तीन sp2 –संकरित कक्षक एक ही तल में 120O के कोण पर व्यवस्थित रहते है | प्रत्येक कार्बन के दो संकरित कक्षक दोनों ओर निकटवर्ती कार्बनो के sp2 –संकरित कक्षक से एव उसका शेष एक sp2 –संकरित कक्षक हैइड्रोजन के s-कक्षक से अतिव्यापन करके तीन σ –आबन्ध बनाते है |
इस प्रकार बेन्जीन के प्रत्येक कार्बन परमाणु पर sp2 –संकरित के पश्चात एक-एक असंकरित एव अवधिपुर्ती p-कक्षक संकरित कक्षक को तल के लम्बवत स्थित रहता है |

निम्नाकित दो प्रकार से p-कक्षक अपने निकटतम कार्बन परमाणुओ से पाशर्व-अतिव्यापन कर तीन π – बन्धो का निर्माण करती है |

चुकि सभी p-कक्षक परस्पर समान दुरी पर स्थित है, अत: प्रत्येक p-कक्षक की निकटवर्ती दोनों कार्बनो के p-कक्षको से अतिव्यापन करने की समान सम्भावना रहती है और वह दोनों और के p-कक्षकसे अतिव्यापन कर लेता है जिससे एक सतत बहूकेन्द्रीय अणु कक्षक में उपस्थित छ: इलेक्ट्रोन सभी कार्बन परमाणुओ पर विस्थानिकर्त (deloclised) रहते है और विस्थानकर्त अणु कक्षक कहते है इसमे पिण्डक (lobes) होते है जिनसे एक वलय के ऊपर एव दूसरा वलय के नीचे स्थित रहता है |

Q. 4. एनिलिन,डाफेनिल एमीन व अमोनिया की क्षारीय शक्ति की तुलना कीजिए |
उत्तर : अमोनिया में नाइट्रोजन का एकाकी युग्म प्रोटॉनीकरण के लिए सरलता से उपलब्ध होता है तथा यह एक प्रोटॉन ग्रहण करके अमोनियम आयन निर्मित करती है। प्रोटॉनीकरण की क्षमता अधिक होने के कारण यह प्रबल क्षारीय होती है।
यद्यपि ऐनिलीन में, नाइट्रोजन परमाणु sp2-संकरित कार्बन परमाणु से संलग्न होता है | तथा इसका एकाकी युग्म बेन्जीन नाभिक के विस्थानित (delocalised) T-कक्षकों के साथ अन्योन्यक्रिया करता है।

यद्यपि ऐनिलीन का प्रोटॉनीकरण होने पर N का एकाकी युग्म इस प्रकार की | अन्योन्यक्रिया हेतु उपलब्ध नहीं होता है अत: ऐनिलिनियम आयन, ऐनिलीन की अपेक्षाकृत कम। स्थायी होता है। इस कारण ऐनिलीन के लिए एक प्रोटॉन ग्रहण करना ऊर्जा की दृष्टि से | लाभदायक नहीं है। प्रोटॉनीकरण की क्षमता (अर्थात् प्रोटॉन ग्रहण करने की क्षमता) कम होने | के कारण ऐनिलीन, अमोनिया की अपेक्षा कम क्षारीय होती है।

ऐनिलीन में इलेक्ट्रॉनग्राही फेनिल समूहों की संख्या बढ़ने के साथ नाइट्रोजन पर एकाकी युग्म की उपलब्धता और कम हो जाती है अत: क्षारकता भी घट जाती है।
अत: ऐनिलीन, डाइफेनिल ऐमीन व अमोनिया की क्षारीय शक्ति का बढ़ता क्रम निम्न होता है
डाइफेनिल ऐमीन < ऐनिलीन < अमोनिया
प्रश्न 5. मेथिल ऐमीन अमोनिया की अपेक्षा अधिक प्रबल क्षार है। क्यों?
उत्तर : ऐमीनों के नाइट्रोजन परमाणु पर विद्यमान एकाकी इलेक्ट्रॉन-युग्म उनकी क्षारीय प्रकृति के लिए उत्तरदायी होता है। इस एकाकी इलेक्ट्रॉन-युग्म को देकर ऐमीन उपसहसंयोजक आबन्ध सरलता से बना लेते हैं। ऐमीनों की एकाकी इलेक्ट्रॉन-युग्म त्यागने की प्रवृत्ति जितनी अधिक होगी, वे उतने ही प्रबल क्षार होंगे।
मेथिल ऐमीन में मेथिल समूह के +[ प्रभाव के कारण नाइट्रोजन परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन-युग्म और अधिक सरलता से उपसहसंयोजक आबन्ध के लिए उपलब्ध हो जाता है। अत: मेथिल ऐमीन अमोनिया की अपेक्षा अधिक प्रबल क्षार है।

प्रश्न 6. इलेक्ट्रॉनस्नेही अभिकर्मक क्या होते हैं? उदाहरण सहित स्पष्ट कीजिए। अथवा इलेक्ट्रॉनस्नेही अभिकर्मकों पर टिप्पणी लिखिए।
उत्तर: इलेक्ट्रॉनस्नेही अभिकर्मक
- इलेक्ट्रॉनस्नेही अभिकर्मक धनावेशित आयन या इलेक्ट्रॉन न्यूनता वाले अणु होते हैं।
- इलेक्ट्रॉनों की कमी के कारण इनमें इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति होती है (Electro = Electron, Philic = Loving)।
- इलेक्ट्रॉन प्राप्त करने के लिए ये सबस्ट्रेट (अभिकारक) अणु के उन परमाणुओं पर आक्रमण करते हैं जहाँ इलेक्ट्रॉन घनत्व अधिक होता है।
- इन्हें लुईस (Lewis) अम्ल तथा इलेक्ट्रोफाइल भी कहा जाता है।
इन अभिकर्मकों में निम्नलिखित सम्मिलित है—
- धनावेशित इलेक्ट्रॉनस्नेही—ये साधारणतयाः धनावेशित होते हैं: जैसे—

आदि।
- उदासीन इलेक्ट्रॉनस्नेही— कुछ उदासीन अणु भी इलेक्ट्रॉनस्नेही के समान व्यवहार कर सकते हैं; जैसे—
(i) यदि केन्द्रीय परमाणु का अष्टक अपूर्ण हो तो ये इलेक्ट्रॉनस्नेही की भाँति व्यवहार करेंगे; जैसे-:CH2 (काबीन), BF3, AICI3, ZnCI2,ICI आदि।
(ii) यदि केन्द्रीय परमाणु पर पूर्ण अष्टक हो, परन्तु उसका केन्द्रीय परमाणु अधिक विद्युत ऋणी परमाणु से जुड़ा हो; जैसे-CO2, SO3, CH3COCI आदि।
(iii) यदि केन्द्रीय परमाणु म खाली d कक्षक हो तो वे इलेक्ट्रॉनस्नेही की मांति व्यवहार करेंगे, जैसे-F2CI3, SiCI4, TiCL4, आदि।
कुछ इलेक्ट्रॉनस्नेही अभिकर्मकों की प्रबलता का क्रम—

प्रश्न 7. नाभिकरनेही व ऐप्वीडेण्ट (उभयधर्मी) नाभिकरनेही क्या होते हैं?
उत्तर: नाभिकस्नेही अभिकर्मक
(i) नाभिकस्नेही अभिकर्मक ऋणावेशित आयन या इलेक्ट्रॉन धनी अणु होते हैं।
(ii) ऋणावेशित होने के कारण ये सबस्ट्रेट (आधार) अणु के उन परमाणुओं पर आक्रमण करते हैं जहाँ इलेक्ट्रॉन घनत्व कम होता है अर्थात् इलेक्ट्रॉनों का अभाव होता है
(Nucleo = Nucleus : धनावेशित केन्द्र, Philic = Loving) |
(iii) इनमें एकाकी इलेक्ट्रॉन युग्म (lone pair of electrons) होते हैं जिससे यह दाता का कार्य करते हैं।
(iv)इन्हें लुईस (Lewis) क्षार भी कहते हैं।
इन अभिकर्मको में निम्नलिखित सम्मिलित है
- ऋणावेशित नाभिकस्नेही— ये साधारणतया ऋणावेशित होते हैं, जैसे- OH–, R– ,.CI–,Br– I– , H–, CN–, HSO3– C–H3, आदि।
- उदासीन नाभिकस्नेही— कुछ उदासीन अणु नाभिकस्नेही की भाँति व्यवहार करते हैं यदि इनके केन्द्रीय परमाणु का अष्टक पूर्ण हो और इस पर एकाकी इलेक्ट्रॉन युग्म विद्यमान हो.
जैसे- H2O, ROH, R—S—R,H2S RSH,NH3, R—NH2, R2NH, R3H आदि।
कुछ नाभिकस्नेही अभिकर्मकों की प्रबलता का क्रम—

ऐम्बीडेण्ट नाभिकस्नेही— ऐसे ऋणायनिक नाभिकस्नेही जिनका ऋणावेश अनुनाद द्वारा दो असमान परमाणुओं या ऐसे समान परमाणुओ, जो समतुल्य न हो, पर विस्थानीकृत (delocalised) रहता है, ऐम्बीडेण्ट (उभयधर्मी) नाभिकस्नही कहलाते है। इस प्रकार के नाभिकस्नेही का एक महत्त्वपूर्ण उदाहरण इनोलेट आयन है उदाहरण के लिए ऐसीटोन के ईनोलेट रूप की अनुनाद संरचना अग्रवत् होती है—

अतः स्पष्ट है कि इस प्रकार के नाभिकस्नेही अभिकर्मकों में दो नाभिकस्नेही केन्द्र उपस्थित होते हैं, परन्तु आक्रमण में एक समय में केवल एक ही नाभिकस्नेही केन्द्र भाग लेता है। ऐसे नाभिकस्नेहियों के अन्य उदाहरण सायनाइड आयन (CN—), नाइट्राइट आयन (NO2—) आदि हैं।
प्रश्न 8. उचित उदाहरण सहित ऐरोमैटिकता के हकल नियम की व्याख्या कीजिए। इस नियम के आधार पर बताइए कि निम्नलिखित यौगिकों/आयनों में कौन ऐरोमैटिक नहीं होगा

अथवा ऐरोमटिकता के लिए हकल नियम को समझाइए।
उत्तर : ऐरोमैटिक यौगिकों में प्रत्यक्ष रूप से चक्रीय तन्त्र के अन्दर द्वि-आबन्ध तथा एकल आबन्ध होते हुए भी गुणों में विरोधाभास होता है। इनके गुण बेन्जीन से काफी मिलते-जुलते हैं। द्वि-आबन्धों के होते हुए भी ये सुगम योग क्रियाएँ न देकर, प्रतिस्थापन क्रियाएँ देते हैं। इस प्रकार के विशिष्ट गुण को ऐरोमैटिक गुण अथवा ऐरोमैटिकता (aromaticity) कहते हैं।
वास्तव में ऐरोमैटिकता sp2-संकरित तलीय वलयों का गुण है जिनमें सभी p—कक्षक परस्पर अतिव्यापन करके एक चक्रीय विस्थानीकत π—इलेक्ट्रॉन तन्त्र बनाते हैं।
ऐरोमैटिकता को स्पष्ट करने के लिए हकल ने एक नियम प्रतिपादित किया। इस नियम के अनुसार, ऐरोमैटिकता दर्शाने के लिए चक्रीय π—इलेक्ट्रॉन धूम्र (π—electron cloud) में (4n+2)π —इलेक्ट्रॉन होने चाहिए, जहाँ पर n = चक्रों की संख्या है जो सर्वदा पूर्ण संख्या जैसे 0,1, 2, 3, 4, …… आदि होती है। इस (4n + 2)π —इलेक्ट्रॉन नियम को हकल का नियम (Huckel’s rule) कहते हैं। इस नियम के अनुसार, ऐरोमैटिक यौगिक में -इलेक्ट्रॉनों की संख्या 2(n = 0), 6(n-1),10(n-2), 14(n = 3), 18(n=4) होती है। बेन्जीन अणु n-1 होता है, अत: π—इलेक्ट्रॉनों की संख्या 6 होती है। हकल का नियम क्वान्टम यान्त्रिकी के द्वारा निर्गत किया गया है और यह सभी यौगिकों की ऐरोमैटिकता को समझाता है। इस नियम । के कुछ उदाहरण अग्रलिखित हैं—
- बेन्जीन– यह एक चक्रीय तलीय यौगिक है। इसमें प्रत्येक कार्बन पर एक p-ऑर्बिटल होता है तथा इसमें तीन द्विक-आबन्ध तथा छ:π—इलेक्ट्रॉन होते हैं। अत: इसमें 6π—इलेक्ट्रॉनों का लगातार चक्रीय धूम्र होता है।
हकल के नियम के अनुसार,
(4n + 2)-इलेक्ट्रॉन हेतु n = 1
π —इलेक्ट्रॉन = 6

अत: यह ऐरोमैटिक यौगिक है जो ऐरोमैटिकता का गुण व्यक्त करता है।
- नैफ्थेलीन— नैफ्थेलीन में 10 कार्बन परमाणु हैं तथा प्रत्येक पर एक p–कक्षक उपस्थित है। इसमें पाँच द्वि-आबन्ध हैं, अत: 10 π—इलेक्ट्रॉन हैं जिनमें से दो π—इलेक्ट्रॉन दोनों चक्रों के लिए उभयनिष्ठ होते हैं। ये सभी परस्पर अतिव्यापन करके एक चक्रीय सतत π—इलेक्ट्रान धूम्र बनाते हैं जो दोनों षट्कोणों के तल के ऊपर तथा नीचे वितरित रहता है। .
अतः हकल के नियम के अनुसार,
(4n + 2) π—इलेक्ट्रॉन हेतु n = 2
π—इलेक्ट्रॉन = 10

अतः यह ऐरोमैटिकता का गुण व्यक्त करती है या नैफ्थेलीन में 10 T-इलेक्ट्रॉन उपस्थित हैं तथा यह सतत चक्रीय अणु है। अत: यह ऐरोमैटिक है।
- पिरिडीन— इसके सभी परमाणु sp2-संकरण में होते हैं। आबन्ध बनने के बाद प्रत्येक के ऊपर एक-एक असंकरित p–कक्षक रह जाता है, अत: इसमें छ: p-कक्षक हैं तथा छ: π—इलेक्ट्रॉन हैं। ये छ: p–कक्षक परस्पर अतिव्यापन करके एक एकल 6π—इलेक्ट्रॉन धूम्र का निर्माण करते हैं जो अणु के तल के ऊपर तथा नीचे वितरित रहता है। अत: पिरिडीन भी एक चक्रीय तलीय यौगिक है।
हकल के नियम के अनुसार,
(4n + 2) π—इलेक्ट्रॉन हेतु n = 1
π—इलेक्ट्रॉन = 6

अत: यह ऐरोमैटिक यौगिक है जो ऐरोमैटिकता का गुण व्यक्त करता है।
- थायोफीन— इसमें S-परमाणु षष्टक को दो इलेक्ट्रॉन प्रदान करता है, अत: पूर्ण इलेक्ट्रॉनों की संख्या छ: हो जाती है जो परस्पर संयुक्त होकर ऐरोमैटिक षष्टक बना लेते हैं।
हकल के नियम के अनुसार,
(4n + 2) π—इलेक्ट्रॉन हेतु. n = 1
π—इलेक्ट्रॉन = 4+2=6

अतः यह ऐरोमैटिक यौगिक है जो ऐरोमैटिकता का गुण व्यक्त करता है।

π—इलेक्ट्रॉनों की संख्या 4 होने के कारण ∎ (साइक्लोब्यूटा-1, 3-डाईन) नॉन ऐरोमैटिक है अर्थात् यह ऐरोमैटिक नहीं है।
प्रश्न 9. समझाइए क्यों क्लोरोऐसीटिक अम्ल, ऐसीटिक अम्ल की अपेक्षा प्रबल अम्ल है?
उत्तर : किसी पदार्थ की अम्लीय सामर्थ्य उसकी हाइड्रोजन आयन देने की क्षमता पर निर्भर करती है। कोई पदार्थ जितनी शीघ्रता से H+ देता है वह उतना ही अधिक अम्लीय होता है।
क्लोरोऐसीटिक अम्ल में ऋणात्मक प्रेरणिक प्रभाव (-I) दर्शाने वाला Cl समूह उपस्थित है जो कार्बोक्सिलिक कार्बन से इलेक्ट्रॉनों को अपनी ओर आकर्षित करके उस पर आंशिक धनावेश उत्पन्न कर देता है तथा कार्बोक्सिलिक कार्बन धनावेशित (इलेक्ट्रॉन न्यून) होने के कारण ऑक्सीजन से हाइड्रोजन के विस्थापन को सुगम बनाता है अर्थात् इसकी अम्लीय सामर्थ्य बढ़ाता है।

ऐसीटिक अम्ल ऐसीटिक अम्ल में —I प्रभाव दर्शाने वाले समूह की अनुपस्थिति के कारण इसमें से प्रोटॉन का निष्कासन अपेक्षाकृत कठिन होता है अत: यह क्लोरोऐसीटिक अम्ल की अपेक्षा दुर्बल अम्लीय होता है।
प्रश्न 10. कार्बोनियम (कार्बोधनायन) में स्थायित्व का क्रम प्रेरणिक प्रभाव व हाइपरकॉन्जुगेशन (अतिसंयुग्मन) से समझाइए।
उत्तर : धनावेशित कार्बन परमाणु युक्त आयन कार्बोनियम आयन कहलाता है। धनावेशित कार्बन परमाणु से जुड़े कार्बन परमाणुओं की संख्या अर्थात् 1, 2, 3 के आधार पर ये क्रमश: 1°, 2° तथा 3° कार्बोनियम आयन कहलाते हैं।
इन आयनों के स्थायित्व के प्रेरणिक प्रभाव तथा हाइपरकॉन्जुगेशन (अतिसंयुग्मन) द्वारा निम्नवत् स्पष्ट किया जा सकता है
- प्रेरणिक प्रभाव (I) के आधार पर-धनावेशित कार्बन से इलेक्ट्रॉन प्रतिकी या इलेक्ट्रॉन दानी समूहों जैसे— CH3 —C2H5, NH2, आदि के जुड़े होने पर कर्बोर्नियम आयन का स्थायित्व बढ़ जाता है क्योंकि ये धनावेश को उदासीन कर दत हा धनावेशित कार्बन पर इलेक्टॉन प्रतिकर्षी समहों (+ प्रभाव दशाने वाले समूहो ) की सख्या बढती जाती है, कार्बोनियम आयन का स्थायित्व बढ़ता जाता है। अत: 1°, 2° तथा 3° कार्बोनियम आयन के स्थायित्व का क्रम निम्नलिखित होता है

इसके विपरीत धनावेशित कार्बन पर इलेक्ट्रॉन प्रतिकर्षी समूहों की संख्या घटने पर कार्बोनियम आयन का स्थायित्व भी घटता है।
.इसके अतिरिक्त धनावेशित कार्बन पर इलेक्ट्रॉन आकर्षी समूह (जैसे —X, —NO2 आदि) उपस्थित होने पर धनावेश में वृद्धि होने के कारण कार्बोनियम आयन का स्थायित्व कम हो जाता है। उदाहरणार्थ, नाइट्रोमेथिल कार्बोनियम आयन का स्थायित्व कार्बोनियम आयन की अपेक्षा कम होता है।

(ii) अतिसंयुग्मन के आधार पर— धनावेशित कार्बन परमाणु से जुड़े अन्य कार्बन परमाणुओं पर हाइड्रोजन परमाणुओं की संख्या अधिक होने पर, अतिसंयुग्मित संरचनाओं की संख्या अधिक होगी, अत: कार्बोनियम आयन (कार्बोधनायन) का स्थायित्व भी अधिक होगा। उदाहरणार्थ,

अत: स्पष्ट है कि 2° कार्बोधनायन, 1° कार्बोधनायन की अपेक्षा अधिक स्थायी है।
इसी प्रकार 3° कार्बोधनायन अर्थात् (CH3)3 C® में 9 अतिसंयुग्मित संरचनाएँ सम्भव हैं अत: 1°, 2° तथा 3° कार्बोधनायनों के स्थायित्व का क्रम निम्न है—

प्रश्न 11. वुट्ज अभिक्रिया पर संक्षिप्त टिप्पणी लिखिए।
उत्तर : वुट्ज अभिक्रिया—-जब ऐल्किल हैलाइड के दो अणुओं (समान या असमान) का सोडियम के साथ शुष्क ईथरीय विलयन में संघनन होता है तो उच्च ऐल्केन प्राप्त हो जाते हैं। . इस विधि के द्वारा सममित ऐल्केनों (एथेन, ब्यूटेन आदि) को प्राप्त किया जा सकता है।

वूतर्ज अभिक्रिया के द्वारा कार्बन-कार्बन शृंखला को बढ़ाया जाता है। इस क्रिया से शुद्ध ऐल्केन प्राप्त नहीं होता है क्योंकि यह अभिक्रिया मुक्त मूलकों (free radicals) के द्वारा सम्पन्न होती है। पृथक्-पृथक् ऐल्किल हैलाइड के दो अणु लेने से तीन भिन्न ऐल्केन बनते हैं—

अभिक्रिया में n —प्रोपाइल क्लोराइड तथा आइसोप्रोपाइल क्लोराइड शुष्क ईथर की उपस्थिति में सोडियम से क्रिया करने पर हेक्सेन के तीन समावयवी बनते हैं।


तृतीयक ऐल्किल हैलाइड यह अभिक्रिया नहीं देते हैं।
क्रियाविधि— इस अभिक्रिया के लिए दो क्रियाविधि प्रस्तुत की गई हैं- .
- आयनिक अभिक्रिया विधि— माध्यमिक कार्बनिक सोडियम यौगिकों का बनना—
C2H5Br+ 2 Na → C—2H5Na+ + NaBr
एथिल सोडियम
C2H5Na+ + BrC2H5 → C2H5→ C2H5 + NaBr
n— न्यूटन.
यह अभिक्रिया Sx2 क्रियाविधि द्वारा होती है। .
C–2H5 + C2H5-Br → [H5Cδ2…..C2H2…..Brδ ] → CH2=CH2 + NaBr
अभिक्रिया मिश्रण में एथेन तथा एथीन का बनना निम्न प्रकार व्यक्त किया जा सकता है—
Na+CH3CH2_ + H—CH2—CH2—Br→CH3CH3 + CH2 = CH2 + NaBr
(ii) मुक्त मूलक अभिक्रिया विधि— इसमें माध्यमिक मुक्त मूलक बनता है।

मिश्रण में एथेन तथा एथीन का बनना निम्न प्रकार व्यक्त किया जा सकता है

यह अभिक्रिया असमानुपातन (disproportionation) या अन्तराण्विक हाइड्रोजनीकरण कहलाती है।
प्रश्न 12. निम्नलिखित पर संक्षिप्त टिप्पणी लिखिए (अ) विकार्बोक्सिलीकरण (ब) कोल्बे की विद्युत-अपघटनी विधि।
उत्तर : (अ) विकार्बोक्सिलीकरण-किसी वसा अम्ल को गर्म करके उसके पिल समह (—COOH group) को कार्बन डाइऑक्साइड के रूप में पृथक कर दन की क्रिया को विकाबोक्सिलीकरण (decarboxylation) कहते है |

इस क्रिया को कम ताप पर करने के लिए किसी वसा अम्ल के सोडियम लवण को बालाइम [जो क्विक लाइम (CaO) को कॉस्टिक सोडा (NaOH) विलयन में भिगोकर प्राप्त माको सखाने पर बनता है तथा जिसका सूत्र NaOH + Cao होता है के साथ गर्म किया जाता है। ऐसा करने से वसा अम्ल की CO2 कार्बोनेट के रूप में अलग होकर ऐल्केन बनाती है।

जब सोडियम ऐसीटेट को सोडालाइम के साथ गर्म करते हैं तो मेथेन प्राप्त होती है—

इसी प्रकार सोडियम प्रोपिओनेट एथेन देता है।

उपर्युक्त को निम्न प्रकार भी व्यक्त कर सकते हैं—

विकार्बोक्सिलेशन की क्रियाविधि— सोडालाइम से प्राप्त OH आयन कार्बन-कार्बन बन्ध का हेटरोलिटिक विखण्डन करता है

इस विधि से प्रयोगशाला में ऐल्केन श्रेणी के निचले सदस्य (low members) किए जाते हैं।
(ब) कोल्बे की विद्यत-अपघटनी विधि— किसी वसा 3 ‘पोटैशियम लवणों के सान्द्र जलीय विलयन का विद्युत-अपघटन विधि-किसी वसा अम्ल के सोडियम अथवा वलयन का विद्युत-अपघटन करने से ऐनोड पर मूल अम्ल के दो ऐल्किल समूहों के योग से बना उच्चतर ऐल्केन प्राप्त होता है। यह अभिक्रिया कोल्बे की | विद्युत-अपघटनी विधि (Kolbe’s electrolytic method, 1849) कहलाती है।

ऐल्केन के अतिरिक्त इस विधि से ऐल्कीन व ऐल्काइन भी प्राप्त किए जाते हैं।
- संतृप्त डाइकार्बोक्सिलिक अम्लों के सोडियम/पोटैशियम लवणों के जलीय विलयनों का विद्युत अपघटन करने पर ऐनोड पर ऐल्कीन प्राप्त होती है।
उदाहरण—

- असंतृप्त डाइकार्बोक्सिलिक अम्लों के सोडियम या पोटैशियम लवणों के जलीय विलयनों का विद्युत-अपघटन करने पर ऐनोड पर ऐल्काइन प्राप्त होती है।

क्रियाविधि— कोल्बे की विद्युत अपघटनी विधि की वास्तविक क्रियाविधि अभी तक भली-भाँति ज्ञात नहीं है। सम्भवतः अभिक्रिया मुक्त मूलक के द्वारा सम्पन्न होती है जैसे पोटैशियम प्रोपिओनेट के विद्युत-अपघटन से n-ब्यूटेन, एथेन, एथिलीन व एथिल प्रोपिओनेट का बनना मुक्त मूलक के द्वारा ही सम्भव है।

ऐनोड पर प्रोपिओनेट आयन आवेश खोकर प्रोपिओनेट मुक्त मूलक बनाता है, जा सममित रूप से टूटकर एथिल मुक्त मूलक और CO2 देता है। एथिल मुक्त मूलक ही अनेक उत्पाद देता है।

ब्यूटेन के अतिरिक्त अन्य उत्पाद भी सूक्ष्म मात्रा में बनते हैं।
कैथोड पर पोटैशियम आयन विसर्जित हो जाता है तथा विलयन को क्षारीय बना देता है।

प्रश्न 13: कोरे-हाउस संश्लेषण क्या है?
उत्तर : कोरे-हाउस विधि असममित ऐल्केनों के संश्लेषण के लिए प्रयोग की जाती है। इस अभिक्रिया में ऐल्किल हैलाइड सबसे पहले लीथियम के साथ ईथर की उपस्थिति में क्रिया करके लीथियम ऐल्किल देता है जो क्यूप्रस आयोडाइड के साथ क्रिया करके लीथियम डाइऐल्किल कॉपर देता है। यह पुन: ऐल्किल हैलाइड के साथ क्रिया करके ऐल्केन देता है।

प्रश्न 14: थिर्यो तथा एरिथ्रो विवरिम समावयवी पर टिप्पणी लिखिए |
उत्तर : एरिथ्रो तथा थ्रियो पूर्व लग्न, एरिथ्रोज एव थिर्योज शक्रराओ से लिए गए है |
यदि दो असमान असममित कार्बन परमाणु युक्त अणु में दोनों असममित कार्बनों पर एक-एक असमान समूह एवं दो-दो समान समूह हों तो उसके समावयवों का विन्यास दर्शाने के लिए एरिथ्रो एवं थ्रियो का उपयोग करते हैं। यदि यौगिक में दोनों असममित कार्बनों पर समूह एक ही ओर स्थित हों तो उसे एरिथ्रो समावयवी कहते हैं और यदि समान सरो शाम हों तो उसे थियो समावयवी कहते हैं। इस प्रकार ऐसे यौगिकों में प्रतिबिम्ब रूप के दो युग्म, एरिथ्रो युग्म एवं थ्रियो युग्म होते हैं जो एक-दूसरे के प्रतिबिम्ब र विवरिम (diastereo) समावयवी कहते हैं।

इस प्रकार ऐसे यौगिकों में प्रतिबिम्ब रूपों के दो जा एक-दूसरे के प्रतिबिम्ब रूप नहीं होते है और इन्हें
उदाहरणार— (1) ∝-क्लोरो-∝’-हाइड्रॉक्सी सक्सिनिक अम्ल के एरिथ्रो एवं थियो। प्रतिबिम्ब रूप निम्नलिखित हैं—

(2) 2, 3-डाइक्लोरोपेन्टेन भी एरिथ्रो एवं थ्रियो प्रतिबिम्ब रूपों में पाया जाता है।

प्रश्न 15. ऐल्कोहॉल के निर्जलीकरण की क्रियाविधि लिखिए।
उत्तर : ऐल्कोहॉलों के निर्जलीकरण की क्रियाविधि— किसी यौगिक से जल का निकल जाना निर्जलीकरण कहलाता है। ऐल्कोहॉलों के निर्जलीकरण से ओलिफीन या ईथर प्राप्त होते हैं। अम्ल की उपस्थिति में ऐल्कोहॉल को गर्म करने पर उसका निर्जलीकरण हो जाता है। यह क्रिया निम्नलिखित दो प्रकार से की जा सकती है—
- ऐल्कोहॉल को सान्द्र H2SO4 या सान्द्र H3PO4 के साथ उच्च ताप पर गम करके।
अथवा
(2) ऐल्कोहॉल की वाष्प को ऐलुमिना (लुईस अम्ल) पर 350-400°C पर प्रवाहित करके।
ऐल्कोहॉल के निर्जलीकरण की क्रियाविधि इस प्रकार है
(I) ओलिफीन का बनना— एथिल ऐल्कोहॉल का अम्ल की उपस्थिति में निर्जलीकरण । करने पर ओलिफोन बनते हैं। निर्जलीकरण की क्रियाविधि अग्रलिखित पदों में पूर्ण होती है—
(i) प्रोटॉनीकृत ऐल्कोहॉल का बनना– अम्ल से प्राप्त प्रोटॉन को ग्रहण कर मोडॉल. प्रोटॉनीकृत ऐल्कोहॉल बनाता है, जिसे ऑक्सोनियम आयन भी कहते हैं।

(ii) द्वितीय पद में प्रोटॉनीकृत ऐल्कोहॉल से एक जल का अणु निकल जाने पर काबोंनियम आयन की प्राप्ति होती है।

(iii) कार्बोनियम आयन से प्रोटॉन का विलोपन— अन्तिम पद में कार्बोनियम आयन हाइड्रोजन सल्फेट आयन के साथ अभिक्रिया कर एक प्रोटॉन मुक्त कर देता है जिससे एथिलीन बन जाती है।

(II) ईथर का बनना–सान्द्र सल्फ्यूरिक अम्ल कम ताप पर ऐल्कोहॉल के आधिक्य से अभिक्रिया करके डाइएथिल ईथर बनाता है।
इस अभिक्रिया की क्रियाविधि निम्न प्रकार है—

- प्रोटॉनीकृत ऐल्कोहॉल का बनना—प्रोटॉनीकृत ऐल्कोहॉल प्राप्त होता है।

- कार्बोनियम आयन का बनना— इस पद में जल के विलोपन से काब आयन बनता है।

- कार्बोनियम आयन की ऐल्कोहॉल अणु से अभिक्रिया— इस पद में ऑक्सोनियम आयन बनता है।

- ईथर का बनना— ऑक्सोनियम आयन से HSO–4 एक प्रोटॉन मुक्त करके ईथर बना देता है।

प्रश्न 16. E तथा Z नोटेशन (विन्यास) को समझाइए तथा निम्नलिखित में E या Z अभिविन्यास बताइए—

उत्तर : ज्यामितीय समावयवियों का विन्यास समपक्ष व विपक्ष रूपों के द्वारा प्रदर्शित किया जाता है। जब दो समान परमाणु या समूह द्विबन्ध के एक पक्ष में होते हैं तो इसे समपक्ष रूप तथा यदि दो समान परमाणु या समूह विपरीत पक्ष में होते हैं तो इसे विपक्ष रूप कहते हैं। जब द्विबन्ध से जुड़े परमाणु या समूह भिन्न-भिन्न होते हैं तो इनके विन्यासों को समपक्ष-विपक्ष रूपों के द्वारा प्रदर्शित नहीं किया जा सकता। इस प्रकार के ज्यामितीय समावयवियों के विन्यासों को E व Z पद्धति के द्वारा व्यक्त किया जाता है। यह पद्धति काहन, इनगोल्ड तथा प्रिलोग द्वारा दिए गए समहों के वरीयता क्रम पर आधारित है। E व Z की व्युत्पत्ति जर्मन शब्दों Entgegen जिसका अर्थ है विपरीत तथा Zusammen जिसका अर्थ है एक साथ, से हुई है। इस पद्धति से किसी ज्यामितीय समावयवी का नामकरण निम्नलिखित प्रकार से किया जाता है—
- प्रत्येक द्विबन्ध युक्त कार्बन परमाणु से जुड़े परमाणु या समूह में अधिक वरीयता वाला (अर्थात् अधिक परमाणु क्रमांक वाला) परमाणु या समूह ज्ञात किया जाता है।
- यदि प्रत्येक कार्बन परमाणु से जुड़े अधिक वरीयता वाले परमाणु द्विबन्ध के एक हीसमावयवी को Z तथा यदि ऐसे परमाणु या समूह विपरीत पक्ष में होते हैं तो उस समावयवी को E के द्वारा प्रदर्शित करते हैं।

जहाँ A व B क्रमशः उच्च व निम्न वरीयता क्रम के परमाणु या समूह हैं।
उदाहरण— (1) माना किसी ऐल्कीन यौगिक में द्विबन्ध कार्बन परमाणुओं से F, Cl, Br व I परमाणु जुड़े हैं—
चूँकि आयोडीन (Z = 53) का परमाणु क्रमांक फ्लुओरीन (Z = 9) के परमाणु क्रमांक से अधिक है, अत: आयोडीन फ्लुओरीन से वरीयता क्रम में पहले आता है। इसी प्रकार ब्रोमीन (Z = 35) का परमाणु क्रमांक क्लोरीन (Z = 17) से अधिक होने के कारण ब्रोमीन वरीयता क्रम में क्लोरीन से पहले आता है। अत: इन समावयवियों के E व 2 विन्यास निम्न प्रकार प्रदर्शित किए जाते हैं—

प्रथम कार्बन परमाणु से जुड़ा – Cl वरीयता क्रम में —OH से पहले आता है तथा दूसरे कार्बन परमाणु से जुड़ा —I वरीयता क्रम में —COOH से पहले आता है। अत: इन समावयवियों के E व Z विन्यास पूर्व वर्णित प्रकार से प्रदर्शित किए जाते हैं।
उपर्युक्त नियमों के आधार पर,

- चूँकि उच्च वरीयता वाले समूह द्वि-आबन्ध के समान ओर स्थित हैं, अतः इसका अभिविन्यास ‘Z’ है।

उच्च वरीयता वाले समूहों के द्वि-आबन्ध के विपरीत ओर स्थित होने के कारण इसका अभिविन्यास ‘E’ है।
प्रश्न 17. निम्नलिखित यौगिकों में R अथवा S-कॉन्फीगुरेशन (अभिविन्यास) निरूपित कीजिए—
उत्तर :

प्रश्न 18. प्रतिबिम्ब समावयवी एवं विवरिम समावयवी पर संक्षिप्त टिप्पणी लिखिए।
उत्तर : प्रतिबिम्ब समावयवी या बिम्ब-प्रतिबिम्ब रूप
किसी यौगिक के वे रूप जो समतल घुवित प्रकाश के तल को घुमा देते हैं, प्रकाशित समावयवी कहलाते हैं तथा ऐसे प्रकाशिक समावयवी जो एक-दूसरे के दर्पण प्रतिबिम्ब बोले परन्त इन प्रतिबिम्बों को एक-दूसरे पर अध्यारोपित नहीं किया जा सकता, प्रतिाब समावयवी या बिम्ब-प्रतिबिम्ब रूप कहलाते हैं।
अत: किसी यौगिक के परस्पर अध्यारोपित न किए जाने वाले प्रतिबिम्ब रूप, इनेन्शियोमर्स कहलाते हैं। उदाहरणार्थ-लैक्टिक अम्ल के इनेन्शियोमर्स (या बिम्ब-प्रतिबिम्ब रूप) निम्नवत् हैं—

इसी प्रकार, टार्टरिक अम्ल के भी बिम्ब-प्रतिबिम्ब रूप निम्नवत् हैं

विवरिम समावयवी
ऐसे यौगिक जो प्रकाशिक समावयवी हैं परन्तु बिम्ब-प्रतिबिम्ब सम्बन्ध व्यक्त नहीं करते, विवरिम समावयवी कहलाते हैं। इनमें असममित कार्बन परमाणुओं की संख्या एक से अधिक होती है।
उदाहरण के लिए, यौगिक CH3CH(OH) CH(OH)COOH में दो भिन्न असममित कार्बन परमाणु हैं जिस कारण यह —H व —OH समूहों के सापेक्ष व्यवस्थाओं के आधार पर निम्नलिखित चार रूपों में पाया जाता है—

उपर्युक्त रूपों में से I व II तथा III व IV बिम्ब-प्रतिबिम्ब सम्बन्ध प्रदर्शित करते ह परन्तु I व III; II व IV; II व III अथवा I व IV प्रकाशिक समावयवी होने पर भा बिम्ब प्रतिबिम्ब सम्बन्ध व्यक्त नहीं करते। अत: ये विवरिम समावयवी होते हैं।
विवरिम समावयवियों के भौतिक, रासायनिक तथा प्रकाशिक गण भिन्न हात हा २९ । प्रभाजी आसवन तथा क्रोमैटोग्राफी विधियों से पृथक् किया जा सकता है।
प्रश्न 19. ध्रुवण घूर्णकता से क्या अभिप्राय है? इसे प्रभावित करने वाले कारकों का वर्णन कीजिए।
उत्तर : ध्रुवण घूर्णकता या प्रकाशिक घूर्णकता (Optical Activity)— प्रयोगों द्वारा | देखा गया है कि कुछ पदार्थों के विलयन अथवा क्रिस्टल जब ध्रुवित प्रकाश के रास्ते में रख दिए जाते हैं तो वे प्रकाश के तल को बायीं या दायीं ओर किसी एक निश्चित कोण पर घुमा देते हैं।

यदि आरम्भ में ध्रुवित प्रकाश की दिशा XY है और विलयन में से निकलने के पश्चात् यह X’Y’ हो जाती है तो ध्रुवित प्रकाश कोण से घूम जाता है। इसे घूर्णन कोण कहते हैं।
यौगिकों के द्वारा समतल ध्रुवित प्रकाश के तल को एक निश्चित दिशा में घुमा देने के गुण को ही प्रकाशिक घूर्णकता कहते हैं। ऐसे सभी पदार्थ जो प्रकाशिक घूर्णकता प्रदर्शित करने का गुण रखते हैं, उनको प्रकाश सक्रिय यौगिक कहते हैं। जो पदार्थ समतल ध्रुवित प्रकाश को बायीं ओर घुमाते हैं, उनको बाएँ ध्रुवण घूर्णक (laevo-rotatory) पदार्थ तथा जो दायीं ओर घुमाते हैं, उनको दक्षिणध्रुवण घूर्णक (dextro-rotatory) पदार्थ कहते हैं। किसी पदार्थ का ध्रुवण घूर्णक ज्ञात करने वाले उपकरण को ध्रुवणमापी (polarimeter) कहते हैं—
किसी पदार्थ या उसके विलयन की घूर्णन क्षमता निम्नलिखित बातों पर निर्भर करती है—
(i) पदार्थ की प्रवृत्ति,
(ii) पदार्थ को विलेय करने वाले विलायक की प्रकृति,
(iii) पदार्थ का सान्द्रण,
(iv) ध्रुवणमापी की नली में भरे पदार्थ या उसके विलयन की लम्बाई,
(v) प्रयुक्त प्रकाश की तरंगदैर्घ्य,
(vi) प्रयोग का तापक्रम।
प्रश्न 20. वाल्डन. प्रतिलोमन या प्रकाशिक प्रतिलोमन पर एक संक्षिप्त टिप्पणा | लिखिए।
उत्तर : वाल्डन प्रतिलोमन या प्रकाशिक प्रतिलोमन— एक प्रकाशिक सक्रिय समावयव केटसरे प्रकाशिक सक्रिय समावयव में परिवर्तन को वाल्डन (प्रतीपन) प्रतिलोमन कहते हैं। अतः
d—समावयवी →I —समावयवी
या
I —समावयवी →d —समावयवी
उदाहरणार्थ— I -क्लोरोसक्सिनिक अम्ल का जब KOH विलयन से जल-अपघटन जाता है तो प्राप्त मैलिक अम्ल विपरीत विन्यास का होगा अर्थात् d-विन्यास का होगा राटि नम Ag2O से जल-अपघटन कराया जाए तो उत्पाद का विन्यास वही होगा जो कि मूल पदार्थ का है। I -मैलिक अम्ल PCl5 से अभिक्रिया करने परd-क्लोरोसक्सिनिक अम्ल देगा। यह वाल्डन प्रतीपन का उदाहरण है।

d-क्लोरोसक्सिनिक अम्ल Ag2O से जल-अपघटित होकर d -मैलिक अम्ल में परिवर्तित होता है। इस अभिक्रिया में उत्पाद व मूल पदार्थ के विन्यास समान हैं, अत: इसमें प्रतीपन नहीं होता है।
निम्नलिखित चार्ट में बताया गया है कि किस अभिक्रिया में प्रतीपन होता है. और किसमें नहीं—

किसी प्रतिस्थापन अभिक्रिया में प्रतीपन होगा या नहीं, यह निम्नलिखित बातों पर आधारित होता है—
(i) अभिक्रिया करने वाले यौगिक की प्रकृति,
(ii) अभिकर्मक की प्रकृति,
(iii) अभिक्रिया की विभिन्न अवस्थाओं पर।
वाल्डन प्रतीपन की क्रियाविधि
वाल्डन प्रतीपन यौगिक में असममित कार्बन पर किसी परमाणु या समूह के SN2 क्रियाविधि से प्रतिस्थापन के कारण होता है। SN2 क्रियाविधि में आक्रमणकारी (attacking group) हटने वाले समूह (leaving group) के पीछे से प्रहार करता है और संक्रमण अवस्था बनाता हुआ प्रतिस्थापन-उत्पाद देता है। संक्रमण अवस्था आक्रमणकारी समूह (हटाने वाला समूह) व हटने वाला समूह, दोनों असममित कार्बन से अर्द्धबन्ध द्वारा जड़े रहते हैं और मक्त कार्बोकैटायन नहीं बनता। यह क्रिया उसी प्रकार होती है जैसे तेज तूफान में छतरी उलट जाती है। इसे I-क्लोरोसक्सिनिक अम्ल से, d-मैलिक अम्ल बनाने के उदाहरण द्वारा आगे दर्शाया गया है।

इस प्रकार जब भी असममित कार्बन पर SN2 क्रियाविधि से प्रतिस्थापन होता है तो वाल्डन प्रतीपन होता है। यह एक सामान्य नियम है।
प्रश्न 21. रेसिमिक तथा मीसो रूप पर संक्षिप्त टिप्पणी लिखिए।
उत्तर : रेसिमिक तथा मीसो रूप— ऐसे यौगिक जिनमें एक या एक से अधिक समान | असममित कार्बन परमाणु होने पर भी वे ध्रुवित प्रकाश के तल को किसी भी दिशा में नहीं। घुमाते, रेसिमिक तथा मीसो रूप कहलाते हैं।
रेसिमिक रूप— यह d- व I-रूपों की तुल्य मात्राओं का मिश्रण होता है। यह बाह्य प्रतिकार के कारण प्रकाशिक अघूर्णक होता है क्योंकि d-रूप ध्रवित प्रकाश के तल को जितना घड़ी की दिशा में घुमाता है, I-रूप ध्रुवित प्रकाश के तल को घड़ी की विपरीत दिशा में उतना ही घुमा देता है।
मीसो रूप— यह केवल एक यौगिक होता है जिसमें दो समान असममित कार्बन परमाणु विद्यमान होते हैं। यह यौगिक भी प्रकाशिक अघूर्णक होता है क्योंकि इसमें सममिति तल या सममिति केन्द्र होता है। इसमें अणु का आधा भाग ध्रुवित प्रकाश के तल को घडी की दिशा में तथा शेष आधा भाग ध्रवित प्रकाश के तल को घड़ी के विपरीत दिशा में घमाता है। यह यौगिक आन्तरिक प्रतिकार के कारण भी प्रकाशिक अघूर्णक होता है। उदाहरण के लिए, टार्टरिक अम्ल के तीन प्रकाशिक समावयवी रूपों में से एक मीसो रूप है।

प्रश्न 22. रेसिमीकरण पर टिप्पणी लिखिए।
उत्तर : रेसिमीकरण
किसी ध्रुवण-घूर्णक पदार्थ के एक ध्रुवण-घूर्णक समावयवी को उसके रेसिमिक मिश्रण में परिवर्तन की क्रिया को रेसिमीकरण कहते हैं जैसे जब (+) लैक्टिक अम्ल के जलीय विलयन को गर्म किया जाता है तो लैक्टिक अम्ल का रेसिमिक मिश्रण प्राप्त होता है।

रेसिमीकरण दोनों समावयवों (+) तथा (-) में से किसी एक को शुरू में लेने से हो सकता है। इसमें लिए गए समावयवी का आधा भाग दूसरे समावयवी में परिवर्तित हो जाता है तथा इस प्रकार रेसिमिक मिश्रण प्राप्त होता है। इसे निम्नलिखित प्रकार से प्रदर्शित कर सकते हैं
2 (+) A → (+) A+ (-) A
अथवा 2 (-) A → (-) A+ (+) A
BSC Organic chemistry Notes
रेसिमिक मिश्रण, सामान्यतः यह क्रिया उन पदार्थों में पायी जाती है जिनमें एक कार्बन परमाणु असममित हो। रेसिमीकरण की क्रिया प्रकाश के प्रभाव से, ताप के प्रभाव से अथवा रासायनिक क्रिया के द्वारा होती है जिनका वर्णन निम्नलिखित है—
- ताप का प्रभाव— रेसिमीकरण की सर्वोत्तम विधि समावयवी के जलीय विलयन को गर्म करना है। ताप बढ़ाने से एक समावयवी आसानी से रेसिमिक मिश्रण में परिवर्तित होजाता है। उदाहरणार्थ-यदि लैक्टिक अम्ल अथवा टार्टरिक अम्ल के किसी एक समावयवी को पानी में घोल कर गर्म किया जाए तो इनका रेसिमिक मिश्रण प्राप्त हो जाता है।
- रासायनिक अभिकर्मकों का प्रभाव— बहुतसे ध्रुवण-घूर्णक पदार्थ रासायनिक अभिकर्मकों के द्वारा रेसिमीकरण प्रदर्शित करते हैं। सामान्यतः अम्ल व क्षार इस कार्य में मुख्य … भूमिका निभाते हैं जैसे (-) लैक्टिक अम्ल पर जलीय KOH की क्रिया से रेसिमीकरण होजाता है तथा d-वैलेरिक अम्ल को सान्द्र H2SO4 के साथ गर्म करने पर उसका रेसिमीकरण हो जाता है।
- स्व:रेसिमीकरण— कुछ पदार्थ बिना किसी रासायनिक अभिकर्मक अथवा बिना गर्म . किए भी सामान्य तापक्रम पर ही रेसिमीकरण प्रदर्शित करते हैं। उदाहरणार्थ— डाइमेथिल ब्रोमोसक्सिनेट सामान्य तापक्रम पर ही रेसिमीकृत हो जाता है। कुछ पदार्थ इतनी आसानी से रासमीकृत होते हैं कि उनका एक समावयवी स्वतन्त्र रूप में प्राप्त करना आसान नहीं होता। इस प्रकार के रेसिमीकरण को स्व:रेसिमीकरण कहते हैं।
कुछ पदार्थ ऐसे भी होते हैं जिन्हें रेसिमीकृत नहीं किया जा सकता, परन्तु । पदार्थों को विभिन्न विधियों से अलग-अलग मात्रा में रेसिमीकत किया जा सकता है |
प्रश्न 23. आपेक्षिक विन्यास (D, L नामकरण) पर संक्षिप्त टिप्पणी लिखिए।
उत्तर : आपेक्षिक विन्यास अथवा D, L नामकरण
एमलाफशर न सन् 1908 ई० में यह माना कि दक्षिण तथा वाम ग्लिसरैल्डिहाइड की निम्नलिखित संरचनाएँ हैं

(+)-ग्लिसरैल्डिहाइड की संरचना में —H तथा –OH आगे की ओर इंगित हैं, —CH2OH पीछे की ओर तथा —CHO सिरे पर है। इसे स्वेच्छा से D-विन्यास (D-configuration) कहा गया है। इसमें – OH दायीं ओर तथा H बायीं ओर है जबकि L-(-)-ग्लिसरैल्डिहाइड संरूपण में —OH बायीं ओर है और H दायीं ओर होता है।
जब असममित पदार्थों का विन्यास ग्लिसरैल्डिहाइड के संरूपण से सम्बन्धित किया जा सकता है तो इन्हें आपेक्षिक विन्यास कहते हैं।
उदाहरण—

इस अनुक्रम में ग्लिसरिक अम्ल अथवा लैक्टिक अम्ल दोनों का ही विन्यास D है। ऊपर की स्कीम में चारों यौगिकों का विन्यास D है क्योंकि चारों में ही —OH दायीं ओर है। अतः उनका आपेक्षिक विन्यास D ही है। ऊपर दी हुई अभिक्रिया से स्पष्ट है कि D-ग्लिसरिक अम्ल व लक्टिक अम्ल दोनों ही वाम घूर्णक हैं परन्तु D-ग्लिसरैल्डिहाइड दक्षिण पूर्णक है। अतः ध्रुवण-घूर्णक चिह्न विन्यास को प्रदर्शित नहीं करता है |
अत: इस यागिकों के D व L विन्यास लिखने को प्रयुक्त किया जाता है जैसे कार्बोहाइड्रेट के विन्यास के लिए ग्लिसरिक ऐल्डिहाइड को मानक माना गया है।
ग्लिसरैल्डिहाइड (1) में OH- समूह, D-ग्लिसरैल्डिहाइड और जब OH-समूह बायीं ओर होता है तब उसे L-ग्लिसरैल्डिहाइड (2) कहते है |
ऐसा सभी यौगिकों में सम्भव नहीं है कि D विन्यास में अणु दक्षिण घूर्णक तथा 1 विन्यास में वाम घूर्णक हों जैसे हाइड्रॉक्सी अम्लों में अणु की संरचना में –-COOH समूह को सबसे ऊपर रखा जाता है। उदाहरण–ग्लिसरिक अम्ल में।

प्रश्न 24. सैटजैफ व हॉफमैन नियमों की विवेचना कीजिए।
अथवा निराकरण के लिए सैटजैफ का नियम समझाइए।
अथवा सैटजैफ नियम अथवा हॉफमैन निराकरण पर संक्षिप्त टिप्पणी लिखिए।
उत्तर : सैटजैफ नियम-इस नियम के अनुसार किसी ऐल्किल हैलाइड के विहाइड्रोहैलोजनीकरण से दो ऐल्कीनों के बनने की सम्भावना होने पर मुख्य रूप से अधिक प्रतिस्थापित ऐल्कीन प्राप्त होता है अर्थात् हाइड्रोजन परमाणु कम हाइड्रोजन युक्त कार्बन परमाणु से निकलता है।

ऐसा ऐल्कीनों के स्थायित्व के अनुसार होता है। द्विबन्ध युक्त कार्बन परमाणु से जितने आधक ऐल्किल समूह जुड़े होते हैं, ऐल्कीन उतना ही अधिक स्थायी होता है।
हॉफमैन नियम
जब चतुष्क ऐल्किल अमोनियम हाइड्रॉक्साइड के विलयन में उस B-कार्बन स हाइड्रोजन पृथक् होता है जिस पर हाइड्रोजन परमाणुओं की संख्या अधिकतम हा असार न्यूनतम प्रतिस्थापित ऐल्कीन मुख्य उत्पाद होता है तो उस निराकरण के नियम नियम कहते हैं।
उदाहरणार्थ—

प्रश्न 25. ऐल्कोहॉलों के निर्जलीकरण की क्रियाविधि की विवेचना कीजिए।
उत्तर : ऐल्कोहॉल का निर्जलीकरण– ऐल्कोहॉल निर्जलीकरण पर प्राय: ओलिफीन बनते हैं। इसके लिए अम्ल एवं उच्च ताप की आवश्यकता पड़ती है इसलिए यह अभिक्रिया सान्द्र H2SO4 (160-170°C) या H3PO4 के साथ उच्च ताप (200°C तक) पर गर्म करने पर होती है अथवा ऐल्कोहॉलों की वाष्पों को तप्त ऐलुमिना पर 360° C पर प्रवाहित करने पर होती है। C—OH समूह के पास वाले कार्बन जिस पर हाइड्रोजन कम होते हैं उससे हाइड्रोजन पृथक् होता है। ऐल्कोहॉलों के निर्जलीकरण की सुगमता का क्रम निम्नवत् है

जल के रूप में उस कार्बन का हाइड्रोजन परमाणु निकलता है जो सबसे कम हाइडोजन से जुड़ा होता है।

क्रियाविधि— यह एक अम्ल उत्प्रेरित अभिक्रिया है, जिसमें ऐल्कीन एवं ईथर बनते हैं। यहाँ एथेनॉल का उदाहरण लेकर उपर्युक्त क्रिया की क्रियाविधि को समझाया गया है।
(a) ऐल्कीनों का बनना-निम्न पदों में अभिक्रिया की क्रियाविधि को स्पष्ट करते हैं—
- प्रथम पद— ऐल्कोहॉल अम्ल से प्राप्त प्रोटॉन से मिलकर प्रोटीनीकृत (prorogated) ऐल्कोहॉल बनाता है जिसे ऑक्सोनियम आयन भी कहते हैं।
-
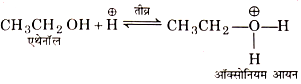
B Sc Organic chemistry Unit 1st Notes - द्वितीय पद-C-O बन्ध निर्बल हो जाने के कारण टूट जाता है और जल का एक अण त्याग कर कार्बोनियम आयन बनाता है।
-

B Sc Organic chemistry Unit 1st Notes - तृतीय पद—कार्बोनियम आयन से एक प्रोटॉन पृथक् हो जाता है तथा ऐल्कीन बन

नोट— (i) प्रोटॉन का त्याग इस प्रकार से होता है कि अत्यधिक स्थायी ऐल्कीन प्राप्त हो। यदि आवश्यकता होती है तो कार्बोनियम आयन का पुनर्विन्यास हो जाता है जो उनके स्थायित्व पर निर्भर करता है। यह पाया गया है कि अत्यधिक प्रतिस्थापियों से युक्त ऐल्कीन ही अधिक बनती है जैसे द्वितीयक ब्यूटिल कार्बोनियम आयन 2-ब्यूटीन देता है।

(ii) एथेनॉल पर सान्द्र H,SO की क्रिया विभिन्न अवस्थाओं में होती है और विभिन्न उत्पाद बनते हैं।
ठण्डे में सान्द्र H2SO4 एथेनॉल से क्रिया करके एथिल हाइड्रोजन सल्फेट बनाता है।
C2H5OH + H2SO4 → C2H5HSO4 + H2O
ठण्डा व सान्द्र एथिल हाइड्रोजन सल्फेट
(a) एथिल हाइड्रोजन सल्फेट को कम दाब पर आसवित करने पर डाइएथिल सल्फेट बनता है।
2C2H5OH + H2SO4→ (C2H5)2 SO4 + 2H2O
(b) एथिल हाइड्रोजन सल्फेट ऐल्कोहॉल के आधिक्य में 140° C पर क्रिया करके डाइएथिल ईथर बनाते हैं।

(c) सान्द्र H2SO4 के आधिक्य में एथिल हाइड्रोजन सल्फेट, H2SO4 का एक अणु खोकर 160-170° C ताप पर ऐल्कीन (एथीलीन) बनाते हैं।

द्वितीयक एवं तृतीयक ऐल्कोहॉल का निर्जलीकरण दो प्रकार से होता है—

BSC Organic chemistry Notes
सामान्यतः जल का अणु सेटजैफ नियम के अनुसार निकलता है। इसके अनुसार, हाइड्रोजन उस पास वाले कार्बन से विलोपित होती है जो सबसे कम हाइड्रोजन परमाणओं से जडा होता है। इसको रिजियोसेलेक्टिविटी (regioselectivity) कहते हैं। अत: 2-ब्यूटीन ही मुख्य उत्पाद होगा।
जब C—OH के पास वाले कार्बन पर हाइड्रोजन परमाणु नहीं होता है तो निर्जलीकरण एवं अणुक पुनर्विन्यास साथ-साथ होते हैं, जैसे-2, 2-डाइमेथिल प्रोपेनॉल-1 निर्जलीकरण पर 2-मेथिल ब्यूटीन-2 देता है। –

विधि-क्रियाविधि— निम्न पदों की सहायता से स्पष्ट की जा सकती है—

तृतीय पद : यह 1°-ऐल्किल कार्बोनियम आयन अधिक स्थायित्व हेतु 3°-कार्बोनियम आयन में पुनर्विन्यास द्वारा परिवर्तित हो जाता है।

BSC Organic chemistry Notes
यह आयन प्रोटॉन देकर स्थायी ऐल्कीन बनाता है।

प्रश्न 26. प्रतिस्थापन की क्रियाविधि लिखिए।
उत्तर : बेन्जीन में इलेक्ट्रॉनस्नेही प्रतिस्थापन–वे अभिक्रियाएँ जिनमें बेन्जीन वलय का एक या अधिक हाइड्रोजन परमाणु किसी इलेक्ट्रॉनस्नेही द्वारा प्रतिस्थापित हो जाता है बेन्जीन की इलेक्ट्रॉनस्नेही प्रतिस्थापन अभिक्रियाएँ कहलाती हैं। ये अभिक्रियाएँ मध्यवर्ती कार्बोधनायन (-संकुल) के निर्माण द्वारा सम्पन्न होती हैं।
क्रियाविधि— इन अभिक्रियाओं के सम्पन्न होने में निम्नलिखित पद प्रयुक्त होते हैं
पद 1—इलेक्ट्रॉनस्नेही का निर्माण— इस पद में उत्प्रेरक या ऊष्मा के प्रभाव द्वारा इलेक्ट्रॉनस्नेही (ED) का निर्माण होता है।

पद 2—बेन्जीन वलय के 𝛑-आबन्ध पर इलेक्ट्रॉनस्नेही का आक्रमण—इस पद में ‘दलेक्टॉनस्नेही बेन्जीन वलय के आ-आबन्ध पर आक्रमण करके 6-संकुल (कार्बोधनायन मध्यवर्ती) बनाता है।

पद 3—विप्रोटॉनीकरण द्वारा π—आबन्ध का पुनर्निर्माण— इस पद में एक C_H आबन्ध का विदलन होता है तथा नया C_C (π) आबन्ध बनता है जिससे वलय पुनः अनुनाद स्थायित्व प्राप्त कर लेता है।

प्रश्न 27. टेफ्लॉन क्या है? टेफ्लॉन के उपयोग एवं बनाने की विधि लिखिए।
उत्तर: टेफ्लॉन–पॉलिटेट्राफ्लुओरो एथिलीन (PTFE) को टेफ्लॉन के नाम से जाना जाता है। यह टेट्राफ्लुओरो एथिलीन का योगात्मक समबहुलक है।
बनाने की विधि— इसका निर्माण टेट्राफ्लुओरो एथिलीन (CF, =CF,) से अमोनियम परसल्फेट उत्प्रेरक की उपस्थिति में उपयुक्त ताप व दाब पर किया जाता है।

उपयोग— इसका प्रयोग ऐसे बर्तनों पर कलई करने हेतु किया जाता है जिन पर भोज्य पदार्थ चिपके नहीं अर्थात् इससे नॉन-स्टिक बर्तन बनाए जाते हैं। इसके अतिरिक्त इसका प्रयोग गैस्केट, वाल्व, सील, नॉन-स्नेहक बियरिंग आदि बनाने में किया जाता है।
प्रश्न 28. साइक्लोप्रोपेन के केला आबन्ध को समझाइए।
उत्तर : साइक्लोप्रोपेन का केला आबन्ध–साइक्लोप्रोपेन बंकित (bent) C—C सहसंयोजी बन्ध का उदाहरण है। बायर के तनाव सिद्धान्त के अनुसार, साइक्लोप्रोपेन का विन्यास एक समत्रिभुज के रूप में होता है जिसका आन्तरिक कोण 60° होता है। उसका तात्पर्य है कि इसमें चतुष्फलकीय कोण पर (109.5° ) से पर्याप्त विचलन है परन्तु कार्बन का एक दुसरे से 90° से कम कोण पर अभिविन्यस्त संकरित ऑर्बिटल सम्भव नहीं है। प्रत्येक कार्बन चार बन्धों द्वारा घिरा रहता है। अत: कोण 90° से अधिक होना चाहिए। इसका अभिप्राय यह है कि साइक्लोप्रोपेन रिंग या वलय में जो आबन्धी परमाण्वीय कक्षक आमने-सामने होती है उनसे सिग्मा बन्ध नहीं बनते हैं। ऐसा दिखाया गया है कि कक्षक इस प्रकार संकरित होते हैं कि वलय का निर्माण करने वाले कक्षकों में संतृप्त अणुओं में कार्बन परमाणुओं के मध्य सामान्य सिग्मा बन्ध बनाने वाले कक्षकों की अपेक्षा p-अभिलक्षण (p-character) अधिक होता है। इससे यह स्पष्ट हो जाता है कि साइक्लोप्रोपेन के कार्बन परमाणु के दो ऑर्बिटलों के मध्य बन्ध कोण 104° होता है जो कि चतुष्फलकीय कोण से थोड़ा कम होता है। अत: साइक्लोप्रोपेन में C-C बन्ध बनाने वाले कक्षकों के सममिति अक्ष ठीक एक-दूसरे की ओर न होकर अणु से बाहर की ओर निकल जाते हैं। इस प्रकार C-C आबन्धी अणु कक्षक अन्तरानाभिकीय अक्षों के सममित नहीं रहते बल्कि केले के समान आकृति बनाते हैं।

C—C बन्ध के निर्माण में भाग लेने वाले परमाण्वीय कक्षकों के उच्चतर p—अभिलक्षण के कारण वलय के चारों ओर π—विस्थानीकरण हो जाता है। यह विस्थानीकरण वलय के तल में ही होता है जबकि ऐरोमैटिक निकाय में π—विस्थानीकरण कार्बन ढाँचे के ऊपर तथा नीचे के तल में होता है। वलय के तल में होने वाला यह विस्थानीकरण वलय को स्थायी बनाता है।
प्रश्न 29. हाइड्रॉक्सिलीकरण अभिक्रिया को उदाहरण सहित समझाइए।
उत्तर : ऐल्कीनों की ठण्डे एवं तनु क्षारीय KMnO4 विलयन या ऑस्मियम टेट्राऑक्साइड के साथ अभिक्रिया कराने पर समपक्ष-1, 2—ग्लाइकॉल बनते हैं। यहा दोनों –OH समूह ऐल्कीन में द्विबन्ध के एक ही तरफ से जड़ते हैं। तनु क्षारीय KMnO4 विलयन को बायर अंभिकर्मक कहते हैं और असंतप्त यौगिक बायर अभिकर्मक कारण । देते हैं। अत: यह अभिकर्मक असंतप्त यौगिकों के परीक्षण में काम आता ह। आस्मियम
टेटाअसम्पाइड (OSO4) ऐल्कीनों के साथ योग करके चक्रीय एस्टर बनाता है जो सोडियम सल्फाइट (दुर्बल अपचायक) के जलीय विलयन से जल अपघटित होकर समपक्ष 2-ग्लाइकॉल देता है। यह अभिक्रिया हाइड्रॉक्सिलीकरण कहलाती है।

एपॉक्साइडों के जल-अपघटन से भी 1, 2 —ग्लाइकॉल प्राप्त होते हैं लेकिन इनमें दोनों —OH समूह विपरीत दिशाओं से जुड़ते हैं अर्थात् विपक्ष-1, 2 —ग्लाइकॉल प्राप्त होते हैं।

प्रश्न 30. एपॉक्सीकरण (एपॉक्साइडेशन) से क्या अभिप्राय है?
उत्तर : एपॉक्सीकरण (Epoxidation)-ऐल्कीन श्रेणी के निचले सदस्यों (lower members) को जब ऑक्सीजन (वायु) के साथ मिश्रित करके 200-400°C तक गर्म कि रजत उत्प्रेरक पर उच्च दाब पर प्रवाहित करते हैं तो ऐल्कीन ऑक्साइड बनाते हैं जिन्हें एपाक्साइड (epoxide) या ऑक्सिरेन कहते हैं। एपॉक्साइड बनने की इस अभिक्रिया के एपॉक्सीकरण कहते हैं।

उपर्युक्त यौगिक ऐल्कीन की परअम्लों (peracids), जैसे परबेन्जोइक अम्ल (C6H5CO3H) अथवा ट्राइफ्लुओरो परऐसीटिक अम्ल (CF3CO3H) की अभिक्रिया से भी ऐल्कीन ऑक्साइड बनते हैं।

प्रश्न 31. ऑक्सीम!रीकरण-विम!रीकरण (अपचयन ) अभिक्रिया को उदाहरण सहित समझाइए।
उत्तर : ऑक्सीमयूरीकरण-विमर्पूरीकरण
ऑक्सीमकयूरिकरण-विमर्पूरीकरण को ऑक्सीमकयूरिकरण-अपचयन भी कहते हैं। इस विधि में ऐल्कीन की THF (टेट्राहाइड्रोफ्यूरेन) विलायक में जलीय मयूंरिक ऐसीटेट के साथ क्रिया कराने पर मयूरिक ऐसीटेट द्विबन्धित कार्बनों से योग करके ऑर्गेनो-म्क्रयुरी योगिक बनाता है। इस क्रिया को ऑक्सीमकयूरिकरण कहते हैं। उत्पाद का क्षारीय सोडियम बाराहाइड्राइड द्वारा अपचयन करने पर ऐल्कोहॉल प्राप्त होता है। इस पद में मर्करी हट जाता है इसे विमक्युरिकरण या अपचयन कहते हैं। इस सम्पूर्ण अभिक्रिया में ऐल्कीन पर जल के अणु का मकोर्निकाफ़ नियमनुसार विपक्ष योग होता है|


जिन ऐल्कीनों से अम्लीय माध्यम में सीधे जलयोजन पर पुनर्विन्यासित उत्पाद प्राप्त होने | की संभावना रहती है उनमें इस विधि से जलयोजन करते हैं जिसमें पुनर्विन्यास नहीं होता।

BSC Organic chemistry Notes
प्रश्न 32. ओजोनीकरण को उदाहरणों द्वारा स्पष्ट कीजिए। अथवा ओजोनीकरण एवं उसके अनुप्रयोग पर टिप्पणी लिखिए।
उत्तर : ओजोनीकरण— यह वह प्रक्रम है जिसके द्वारा ओजोन की सहायता से कार्बन-कार्बन द्वि-बन्ध को तोड़कर दो कार्बोनिल यौगिकों का मिश्रण प्राप्त किया जाता है। वास्तव में, ओजीनी-अपघटन प्रक्रम में ओजोनीकरण (ओजोनाइड निर्माण) तथा प्राप्त उत्पाद का कार्बोनिल यौगिकों में अपघटन सम्मिलित होता है।
जब ऐल्कीन को किसी अक्रिय कार्बनिक विलायक (जैसे—ईथर, CCI4) में विलेय करके निम्न ताप पर ओजोन प्रवाहित की जाती है तो द्वि-आबन्ध (double bond) के आर-पार (across) योग होने से ओजोनाइड बनते हैं। इनमें ऐल्कीन के द्वि-आबन्ध पर ओजोन के अणु का योग होता है। इस अभिक्रिया को ओजोनीकरण कहते हैं।

ओजोनाइड ओजोनाइड (ozonide) जल के साथ गर्म करने पर जल-अपघटित होकर ऐल्डिहाइड, कीटोन अथवा दोनों का मिश्रण देते हैं। जल-अपघटन अभिक्रिया में ओजोनाइड द्वि-आबन्ध का मल (original) स्थिति में टूटता है। इस प्रक्रिया को ओजोनी-अपघटन कहते हैं।

अभिक्रिया में बना H2O2 ऐल्डिहाइड को अम्ल में ऑक्सीकृत कर देता है, अत: इसको रोकने के लिए H2O2 को जिंक डालकर नष्ट कर दिया जाता है।
H2O2, + Zn → ZnO + H2O
ओजोनाइड को Pd उत्प्रेरक की उपस्थिति में H2 से अपचयित करके भी ऐल्डिहाइड अथवा कीटोन प्राप्त किए जा सकते हैं।

यदि ओजोनीकरण में बने ऐल्डिहाइड अथवा कीटोन को पृथक् करके निश्चित कर लिया जाए तो मूल ऐल्कीन में द्वि-आबन्ध की वास्तविक स्थिति को ज्ञात कर सकते हैं।

प्रश्न 33. निम्नलिखित यौगिकों में विद्यमान कार्बन परमाणुओं की संकरण (hybridisation) अवस्था बताइए



प्रश्न 34. निम्नलिखित यौगिकों के प्रत्येक कार्बन परमाणु की संकरण अवस्था लिखिए—

प्रश्न 35. निम्न यौगिकों के IUPAC पद्धति के अनुसार नाम लिखिए—
Image
प्रश्न 36. निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए
Image
प्रश्न 37. निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए
Image
प्रश्न 38. डी०डी०टी० व बी०एच०सी० (BHC) का पूरा नाम व बनाने की वित लिखिए।
अथवा डी०डी०टी० का पूरा नाम, बनाने की विधि व उपयोग लिखिए।
अथवा डी०डी०टी० पर संक्षिप्त टिप्पणी लिखिए।
अथवा बी०एच०सी० का पूरा नाम, बनाने की विधि व उपयोगों का वर्णन कीजिए।
उत्तर : डी०डी०टी०
(p, p‘-डाइक्लोरो डाइफेनिल ट्राइक्लोरो एथेन)
क्लोरोबेन्जीन सान्द्र H2SO4 की उपस्थिति में क्लोरल (ट्राइक्लोरो ऐसीटेल्डिहाइड) के साथ संघनित होकर p, p1—डाइक्लोरो डाइफेनिल ट्राइक्लोरो एथेन बनाती है। इसको ही डी०डी०टी० कहते हैं।

गुण व उपयोग–यह एक सफेद चूर्ण है जो पानी में अविलेय तथा तेलों में विलेय होता है। इसका गलनांक 74-75°C होता है। इसका उपयोग गन्ना तथा खाने वाली फसलों के लिए कीटनाशक के रूप में होता है। यह मच्छरों तथा अन्य कीटों को मार देती है। इसका आयरन द्वारा विघटन हो जाता है इस कारण इसको आयरन के पात्रों में एकत्रित नहीं करते हैं। इसका जैविक-अपघटन नहीं होता है। अत: बहुत से देशों में इसका उपयोग प्रतिबन्धित है।
बी०एच०सी०
(बेन्जीन हेक्साक्लोराइड या गैमेक्सीन)
रासायनिक दृष्टि से बी०एच०सी० या गैमेक्सीन या 1, 2, 3, 4, 5, 6 हेक्साक्लोरो साइक्लोहेक्सेन का y-समावयवी है। यह सूर्य के प्रकाश में बेन्जीन को क्लोरीन के साथ गम करने पर प्राप्त होता है।

यह एक तीव्र कीटनाशी है, जो डी०डी०टी० से भी अधिक प्रभावशाली है। अत: इसका उपयोग मुख्यतः एक कीटनाशी के रूप में किया जाता है। इसका उपयोग कृषि में मिट्टी के साथ करके कीटों को मारने में किया जाता है।
प्रश्न 39. टॉलूईन के नाभिकीय तथा पार्श्व श्रृंखला क्लोरीनीकरण को समझाइए।
उत्तर : (i) टॉलूईन का नाभिकीय क्लोरीनीकरण— जब प्रतिस्थापन अभिक्रिया में टॉलईन के बेन्जीन नाभिक के C-Hबन्ध से हाइड्रोजन का प्रतिस्थापन क्लोरीन परमाणु द्वारा होता है तो इस नाभिकीय प्रतिस्थापन को टॉलूईन का नाभिकीय क्लोरीनीकरण कहते हैं। यह सामान्य ताप पर सूर्य के प्रकाश की अनुपस्थिति तथा हैलोजेन वाहक (FeCl3 या AICl3 या I2 या Fe) की उपस्थिति में होता है जिससे 0-क्लोरो तथा p-क्लोरो टॉलूईन का मिश्रण प्राप्त होता है।

(ii) टॉलूईन का पार्श्व श्रृंखला क्लोरीनीकरण-टॉलूईन में पार्श्व रूप में बेन्जीन नाभिक पर जुड़े मेथिल समूह से जब हाइड्रोजन का प्रतिस्थापन क्लोरीन परमाणु द्वारा होता है तो इस प्रतिस्थापन अभिक्रिया को टॉलूईन का पाव श्रृंखला प्रतिस्थापन कहते हैं। इस प्रतिस्थापन में सूर्य के प्रकाश की उपस्थिति में उबलती टॉलूईन में क्लोरीन गैस प्रवाहित करने पर मेथिल समूह के हाइड्रोजन परमाणु एक-एक करके क्लोरीन परमाणुओं से प्रतिस्थापित होकर क्रमश: बेन्जिल क्लोराइड, बेन्जल क्लोराइड तथा बेन्जोट्राइक्लोराइड बनाते हैं।

BSC Organic chemistry Notes
प्रश्न 40. नैफ्थेलीन से आप -नैफ्थॉल और ऐस्प्रीन कैसे प्राप्त करेंगे?
उत्तर : (i) नैफ्थेलीन से -नैफ्थॉल


BSC Organic chemistry Notes
प्रश्न 41. समझाइए विनाइल क्लोराइड, एथिल क्लोराइड के सापेक्ष नाभिकस्नेही, अभिक्रियाओं में नाभिकस्नेही के प्रति कम क्रियाशील क्यों है? .
उत्तर : विनाइल क्लोराइड, एथिल क्लोराइड की अपेक्षा नाभिकस्नेही अभिक्रियाओं में नाभिकस्नेही के प्रति कम क्रियाशील होता है। इसकी कम क्रियाशीलता निम्नलिखित दो कारणों की सहायता से स्पष्ट की जा सकती है (i) विनाइल क्लोराइड में क्लोरीन परमाणु के + M प्रभाव के कारण यह निम्नांकित
अनुनाद संरचनाएँ देता है—

अत: यह दोनों अनुनादी संरचनाओं (I) व (II) का अनुनादी संकरण है। इन संरचनाओं में संरचना (II) में, क्लोरीन पर धनात्मक आवेश आता है तथा यह कार्बन से द्विबन्ध द्वारा जुड़ा होता है जिससे बन्ध दूरी का घटना व्यक्त होता है। इन कारणों से यह क्लोरीन कार्बन के साथ अधिक आकर्षण से जुड़ा होता है जो नाभिकस्नेही द्वारा प्रतिस्थापित नहीं किया जा सकता है। –
(ii) विनाइल क्लोराइड में क्लोरीन का p-कक्षक द्विबन्धित कार्बन के अप्रयुक्त -कक्षक के साथ पार्श्व अतिव्यापन कर लेता है जिससे कार्बन और क्लोरीन के मध्य द्विबन्ध का निर्माण हो जाता है जिससे यह बन्ध मजबूत हो जाता है, फलस्वरूप नाभिकस्नेही से प्रतिस्थापित नहीं होता है, अर्थात् निष्क्रिय रहता है।

Inorganic Chemistry
|
|
||||||
 |
 |
 |
 |
 |
 |
 |